
科目: 来源: 题型:选择题
| 物质(括号内为杂质) | 除杂方法 | |
| A | NaCl(泥沙) | 溶解、过滤、蒸发 |
| B | FeCl2(CuCl2) | 加入适量铁粉 |
| C | 熟石灰中有少量生石灰 | 加入适量的水 |
| D | CO2(CO) | 通入澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 没有空气污染 | B. | 减少酸雨危害 | C. | 消除温室效应 | D. | 渡过能源危机 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 小宇同学推测气体是氢气并检验 | |
| B. | 小琪同学猜想CuCl2溶液呈酸性并测定 | |
| C. | 小寒同学认为气体是氨气并检验 | |
| D. | 小梁同学认为红色物质是铜并检验 |
查看答案和解析>>
科目: 来源: 题型:解答题
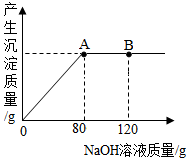 甲、乙两个化学研究小组的同学对生活中的一些金属材料,进行了一系列的研究.
甲、乙两个化学研究小组的同学对生活中的一些金属材料,进行了一系列的研究.查看答案和解析>>
科目: 来源: 题型:推断题
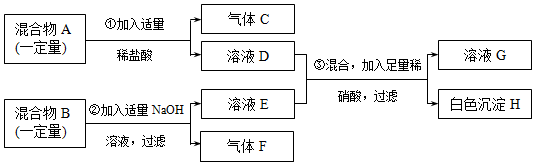
查看答案和解析>>
科目: 来源: 题型:实验探究题
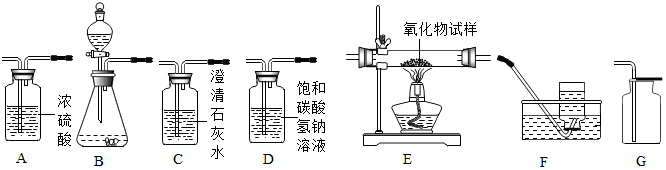
查看答案和解析>>
科目: 来源: 题型:解答题
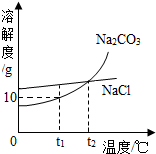
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 40g | B. | 30g | C. | 27.8g | D. | 20 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滤液中一定有3种金属阳离子 | B. | 滤液颜色一定为浅绿色 | ||
| C. | 滤渣中一定只含有单质银 | D. | 滤渣中一定不含锌、铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com