
科目: 来源: 题型:实验探究题
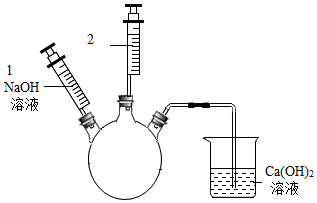
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
 利用如图装置进行实验.
利用如图装置进行实验.查看答案和解析>>
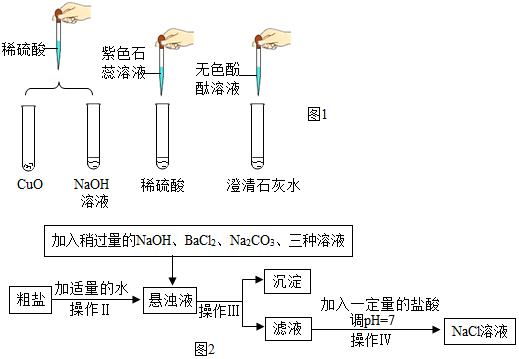
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量甲实验所得溶液于试管中,并往试管中加入锌粒 | 观察到有气泡产生 | 猜想2正确 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
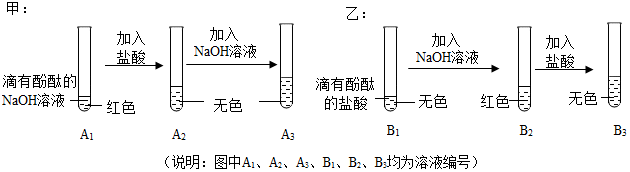
| 探究环节 | 甲同学的探究 | 乙同学的探究 |
| 提出问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
| 作出猜想 | 实验过程中,酚酞变质了 | 猜想一:NaCl 猜想二:NaCl、HCl |
| 实验验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想不成立(填“成立”或“不成立”). (2)你认为,在常温下A2溶液测出的pH应<(填“大于”、“=”、“<”)7. | 取少量B3溶液加入盛有少量铁粉的试管中,观擦到有无色气体产生,固体逐渐减少,溶液由无色变为浅绿色,有关化学方程式是Fe+2HCl═FeCl2+H2↑. 据此,你认为乙同学的猜想二(填“一”或“二”)成立. |
| 交流反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是HCl+NaOH═NaCl+H2O. (2)A3溶液未变红,你认为原因是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和. (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制. | |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验探究题
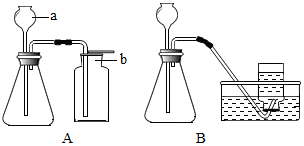 如图是实 验室制取气体的常用装置.请回答:
如图是实 验室制取气体的常用装置.请回答:查看答案和解析>>
科目: 来源: 题型:推断题
| 气体 | 相对分子质量 | 标况下密度(g/L) | 收集方法 |
| 空气 | 29 | 1.293 | 排水集气法 |
| 氧气 | 32 | 1.429 | 向上排空气法 |
| 二氧化碳 | 44 | 1.964 | 向上排空气法 |
| 氢气 | 2 | 0.089 | 向下排空气法 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com