
科目: 来源: 题型:实验探究题
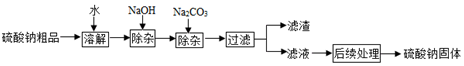
查看答案和解析>>
科目: 来源: 题型:实验探究题
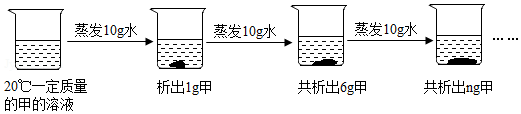
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:解答题
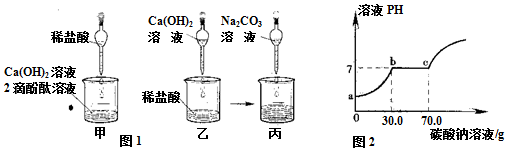
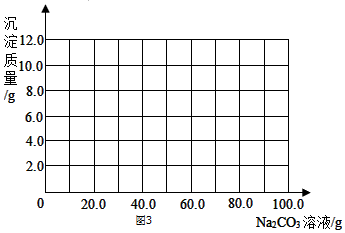
查看答案和解析>>
科目: 来源: 题型:选择题
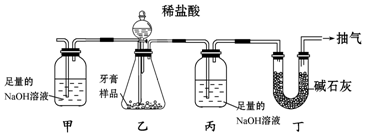
| A. | 省去装置甲和丁 | |
| B. | 将丙中的NaOH溶液换成Ca(OH)2溶液 | |
| C. | 滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2 | |
| D. | 装置乙不再产生气泡时,立即停止抽气 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
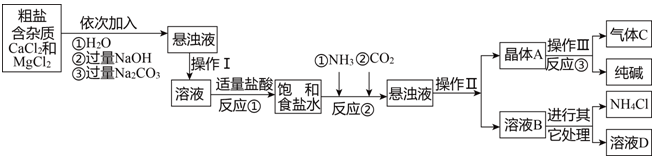
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20.58% | B. | 19.6% | C. | 98% | D. | 22.86% |
查看答案和解析>>
科目: 来源: 题型:填空题
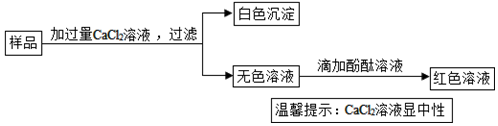
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com