
科目: 来源: 题型:解答题
| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 氯化钠 | 35.7 | 36.0 | 37.3 | 38.4 | 39.8 | 39.8 |
| 硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
查看答案和解析>>
科目: 来源: 题型:实验探究题
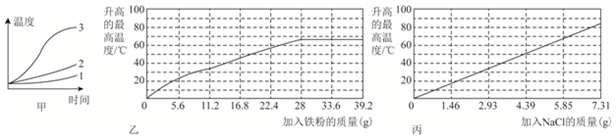
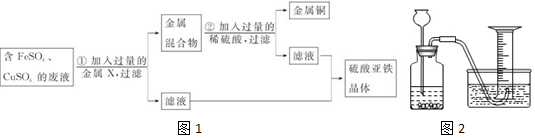
查看答案和解析>>
科目: 来源: 题型:实验探究题
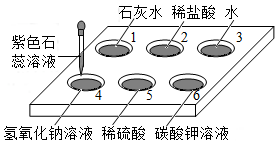 如图所示,在白色点滴板1-6的孔穴中,分别滴加2滴紫色石蕊溶液.
如图所示,在白色点滴板1-6的孔穴中,分别滴加2滴紫色石蕊溶液.查看答案和解析>>
科目: 来源: 题型:实验探究题
 学习了脂肪、糖类和蛋白质在生物体内的作用的相关内容后,小应依据《科学》教材进行了如下实验:
学习了脂肪、糖类和蛋白质在生物体内的作用的相关内容后,小应依据《科学》教材进行了如下实验:查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:填空题
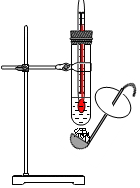
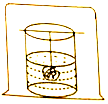 如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).
如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com