
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
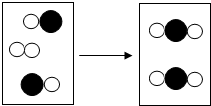 如图是密闭体系中某反应的微观示意图.
如图是密闭体系中某反应的微观示意图. 和
和 分别表示不同的原子.
分别表示不同的原子.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
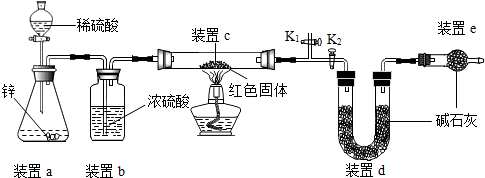
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
查看答案和解析>>
科目: 来源: 题型:填空题
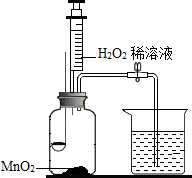 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.| 内容步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭 点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 一定不存在Ba2+ | B. | 无法确定CO32-是否存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 待区分的物质 | 鉴别方法 |
| A | 合成纤维和纯羊毛 | 取样,分别灼烧,并闻气味 |
| B | CaCl2溶液和NaCl溶液 | 取样,分别加入硝酸银溶液,观察是否产生沉淀 |
| C | 稀盐酸和稀硫酸 | 取样,分别AgNO3溶液,观察是否产生沉淀 |
| D | 碳粉和氧化铜 | 取样,分别加入足量稀硫酸,观察是否能溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com