
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 稀盐酸 | 铜 | 过滤 |
| B | 铜粉 | 铁粉 | 过量稀硫酸溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 一氧化碳 | 二氧化碳 | 通过足量灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{100-3a}{3}$% | B. | $\frac{2(100-a)}{3}$% | C. | (100-3a)% | D. | $\frac{100-a}{3}$% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三氯生是一种氧化物 | |
| B. | 三氯生是由碳、氢、氯、氧四种元素组成的 | |
| C. | 三氯生是由24个原子构成的 | |
| D. | 三氯生中碳、氢、氯、氧元素的质量比为144:7:101:32 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 5 | D. | 6 |
查看答案和解析>>
科目: 来源: 题型:解答题
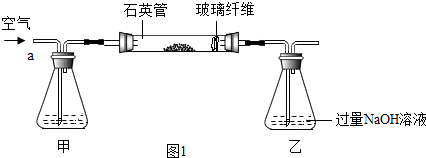
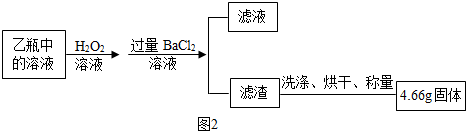
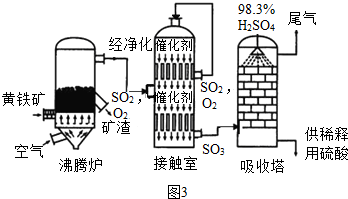
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
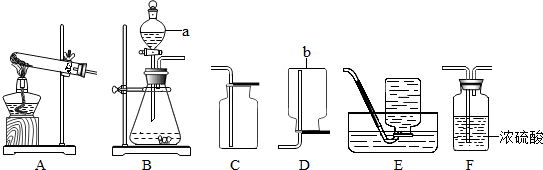
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com