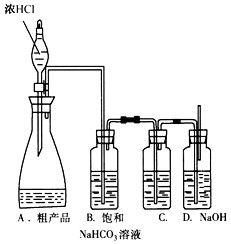
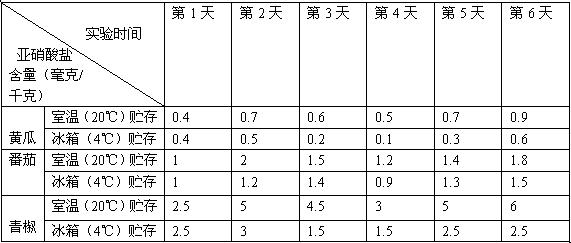
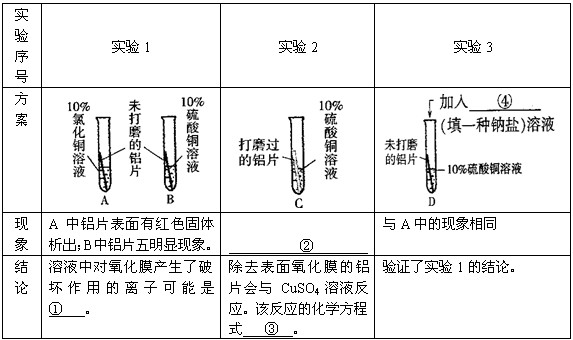
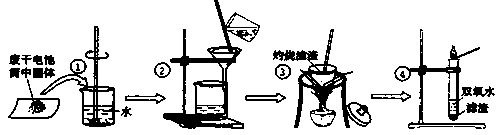铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来.一氧化碳还原氧化铁的化学方程式为 _________ .某化学兴趣小组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究.
【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为 _________ .为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全.
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末.一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中.
②装置A和B两组实验同时开始进行.在装置B的反应中,实验开始前应先 _________ (选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是 _________ .
【实验现象】当装置B的玻璃管中固体完全由 _________ 时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有 _________ .
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因.
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个: _________ .
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生.为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是 _________ (选填字母,装置可重复使用).经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2,因此装置A的不足之处是 _________ .
【拓展延伸】乙同学用下图装置测定铁的相对原子质量,主要实验步骤如下(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录c中液面刻度(c为带有刻度的玻璃管);
④由a向b中滴加稀硫酸至过量;
⑤待b中不再有气体产生并恢复至室温后,记录c中液面刻度,计算得到气体的体积为V mL(经查,室温室压下该气体密度为ρ g/L).
(1)检验该装置气密性的方法是 _________ .
(2)为使测得的气体体积更精确,记录c中液面刻度时,除使视线与凹液面的最低处相平外,还应 _________ .
(3)如果实验过程中,发现稀硫酸的量不足,应 _________ (选填“中途加酸”或“重新实验”).
(4)丙同学发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是 _________ .




 CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和 _________ .
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和 _________ .