
科目: 来源: 题型:选择题
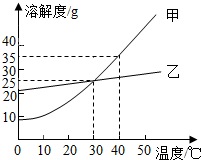 甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )| A. | 40℃时甲的溶解度比乙的大 | |
| B. | 将甲、乙的饱和溶液40℃降到30℃,析出的甲的质量大 | |
| C. | 升高温度可将甲的饱和溶液变为不饱和溶液 | |
| D. | 30℃时,甲和乙的饱和溶液各100g,其溶质的质量相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钠、纯碱、小苏打、Na2CO3 | B. | 碳酸钙、生石灰、石灰石、CaCO3 | ||
| C. | 氢氧化钠、烧碱、火碱、苛性钠、NaOH | D. | 氢氧化钙、熟石灰、碱石灰、Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体的形状发生改变,质量不变 | B. | 溶液中溶质的质量分数增大 | ||
| C. | 晶体质量减少 | D. | KNO3溶质的溶解度改变 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 装置C的质量 | 装置D的质量 | |
| 步骤③ | 292.4g | 198.2g |
| 步骤⑥ | 296.9g | 207.0g |
查看答案和解析>>
科目: 来源: 题型:解答题
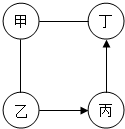 如图中甲、乙、丙、丁是初中化学中常见的物质,均由两种或三种元素组成,其中甲是胃液中帮助消化的成分,乙俗称消石灰.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
如图中甲、乙、丙、丁是初中化学中常见的物质,均由两种或三种元素组成,其中甲是胃液中帮助消化的成分,乙俗称消石灰.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com