
科目: 来源: 题型:解答题
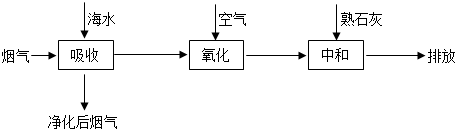
| 实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g•L-1 | 脱硫率/% |
| I | 25 | 2.5 | 99.5 |
| II | 25 | 3.2 | 97.1 |
| III | 40 | 2.5 | 94.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是一盏废旧台灯,某实验小组同学利用它进行观察分析并完成相关实验.
如图是一盏废旧台灯,某实验小组同学利用它进行观察分析并完成相关实验.查看答案和解析>>
科目: 来源: 题型:解答题
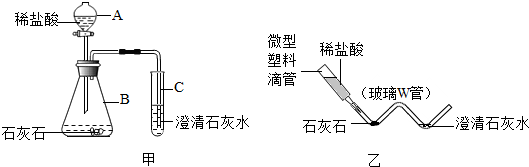
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将草木灰(含K2CO3)与氯化铵混合施用 | |
| B. | 纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产 | |
| C. | 用石灰乳粉刷墙壁 | |
| D. | 用稀硫酸“酸洗”除去钢铁表面的铁锈 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C→CO→CO2 | B. | NaCl→NaNO3→Na2CO3 | ||
| C. | Cu→CuO→CuSO4 | D. | CaCO3→CaO→Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3O-3个氧元素 | B. | $\stackrel{+3}{Fe}$-1个铁离子 | ||
| C. | O3-3个氧原子 | D. | SO3-1个三氧化硫分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
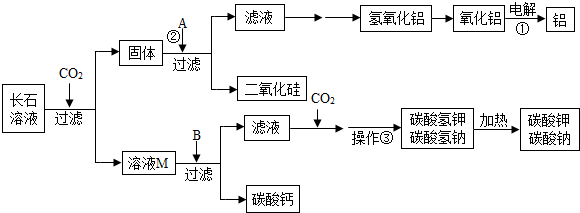
查看答案和解析>>
科目: 来源: 题型:解答题
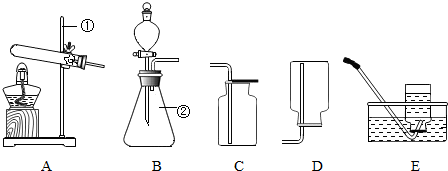
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g 加入5mL6%的H2O2溶液 | 剧烈反应,放热 产生大量气泡 | 生成物中的MnO2 催化分解H2O2 |
| 2 | 取0.2g MnO2 加入5mL6% (H2O2质量分数)的H2O2溶液 | 平稳反应,放热,持续产生气泡 | MnO2 催化 分解H2O2 |
| 3 | 取反应后固体剩余物1.0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 MnO2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com