
科目: 来源: 题型:选择题
| A. | -2 | B. | +2 | C. | +4 | D. | +6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 炒菜时,油锅着火,立即盖上锅盖 | |
| B. | 图书室内文字资料起火,立即用泡沫灭火器灭火 | |
| C. | 发生一氧化碳中毒,立即转移到通风的地方救治 | |
| D. | 如果浓硫酸沾到皮肤上,先用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
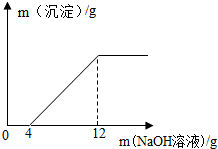 取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的NaOH溶液,产生沉淀质量与滴入NaOH溶液质量的关系如图所示.
取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的NaOH溶液,产生沉淀质量与滴入NaOH溶液质量的关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
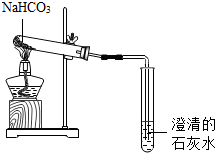 Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).
Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
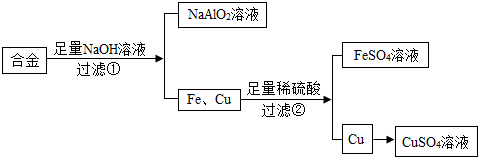
查看答案和解析>>
科目: 来源: 题型:填空题
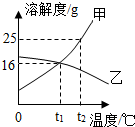 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com