
科目: 来源: 题型:解答题
| 称量的产品质量/g | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
| 加入纯碱产品质量/g | 3.6 | 7.2 | 14.4 | 16.4 |
| 烧杯中剩余物的质量/g | 52.5 | 55 | 60 | 62 |
查看答案和解析>>
科目: 来源: 题型:解答题
实验一 | 实验二 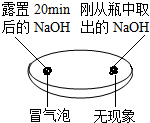 | 实验三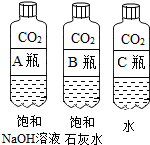 |
| 观察固体表面 | 向两块固体表面滴加稀盐酸 | 振荡三个塑料瓶 |
| 方案一 | 方案二 | 分析 |
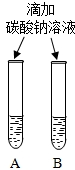 | 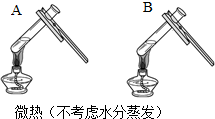 | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为饱和氢氧化钙溶液; 方案二的A溶液变浑浊的原因是氢氧化钙的溶解度随温度升高而减少;氢氧化钠的溶解度随温度升高而升高;两者的溶解度受温度影响情况不同 |
查看答案和解析>>
科目: 来源:【全国市级联考】山东省寿光市2017届九年级学业水平模拟考试(一模)化学试卷 题型:信息分析题
工业上制作印制板是利用氯化铁腐蚀Cu的原理:化学反应方程式为2FeCl3+Cu═2FeCl2+CuCl2.工业生产过程中产生的废液对环境有污染,为了节约金属资源并减少对环境的污染,下面为你设计了一个实验处理废液回收Cu和FeCl2的流程图.查阅资料:Fe+2FeCl3═3FeCl2.请你完善该设计图:
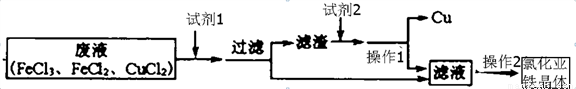
试剂1是 ________ 试剂2是______ 操作1是________ 操作2是______。
查看答案和解析>>
科目: 来源: 题型:解答题
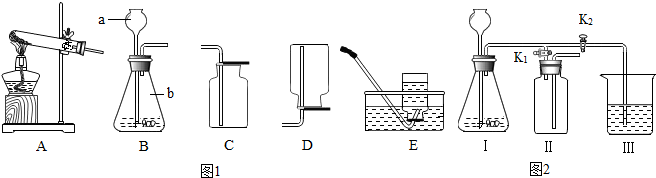
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量二氧化碳与超氧化钾反应后的固体于试管中,滴加适量稀盐酸,并将产生的气体通入澄清石灰水中. | 石灰水变浑浊 | 猜想③是正确的. |
查看答案和解析>>
科目: 来源: 题型:解答题
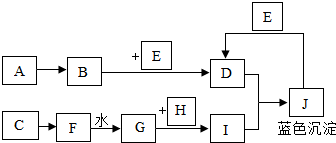
查看答案和解析>>
科目: 来源: 题型:解答题
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | BaCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 不溶 |
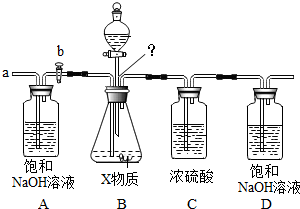
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com