
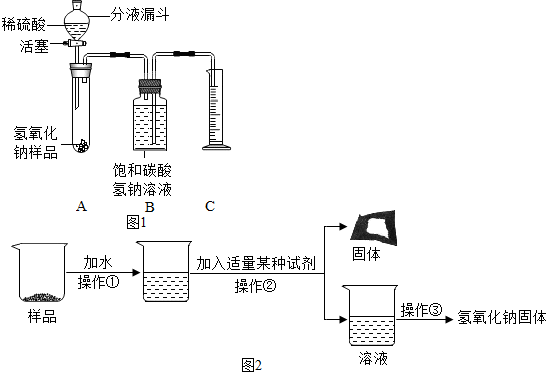
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
 构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:
构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色食品不含任何化学物质 | |
| B. | 胃酸过多的患者可以服用含Al(OH)3的药剂 | |
| C. | 用甲醛溶液作肉类食品的保鲜剂 | |
| D. | “过滤”能将硬水转化成软水 |
查看答案和解析>>
科目: 来源: 题型:解答题
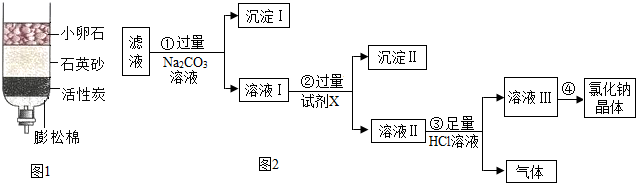
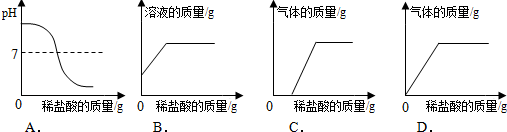
查看答案和解析>>
科目: 来源: 题型:解答题



 ”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.查看答案和解析>>
科目: 来源: 题型:解答题
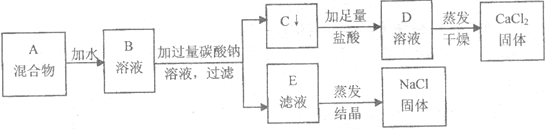
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com