
科目: 来源: 题型:解答题
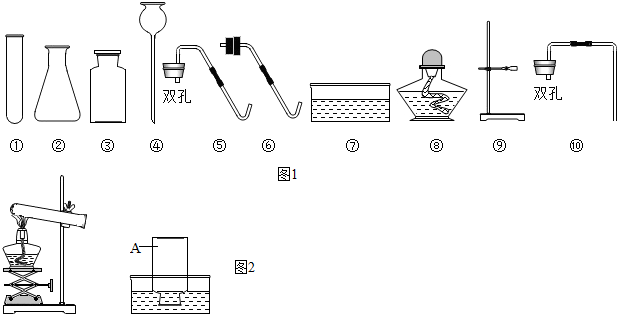
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
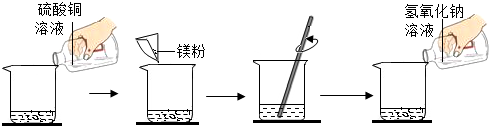
| 第一次 | 第二次 | |
| 加入l0%硫酸铜溶液的质量 | m | m |
| 加入镁粉的质量 | 1.2g | 2.4g |
| 加入氢氧化钠溶液质量 | 80g | 80g |
查看答案和解析>>
科目: 来源: 题型:解答题
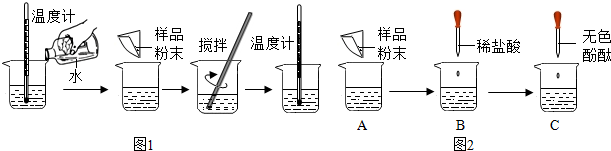
查看答案和解析>>
科目: 来源: 题型:解答题
 ”表示两种物质可以发生反应,用“
”表示两种物质可以发生反应,用“ ”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.
”表示一种物质反应生成另一种物质,如图所示.已知:A与E能发生置换反应,B与A、C反应均有气泡生成.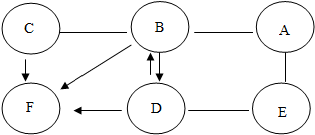
查看答案和解析>>
科目: 来源: 题型:解答题
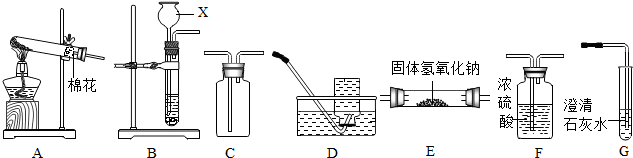
查看答案和解析>>
科目: 来源: 题型:解答题
| 操作步骤 | 实验现象 | 实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 | A中无明显现象 B中有气体 C中有白色沉淀 | A中物质是食盐水 B中物质是稀盐酸 C中物质是澄清石灰水 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 猜想一: K2CO3溶液显 碱性 | 取少量K2CO3溶液 于试管中,滴入2-3 滴酚酞试液,振荡 | 无色变红色 | 溶液显碱性 |
| 猜想二: 能与酸反应 | 取少量K2CO3溶液 于试管中,然后滴加 稀盐酸 | 有大量气泡产生 | 化学方程式 K2CO3+2HCl=2KCl+H2O+CO2↑ |
| 猜想三: 能与Ca(OH)2 反应 | 取少量K2CO3溶液 于试管中,滴加澄清 石灰水 | 产生白色沉淀 | 化学方程式 Ca(OH)2+K2CO3=CaCO3↓+2KOH |
| 猜想四: 能与BaCl2反 应 | 取少量K2CO3溶液于试管中,滴加2-3滴氯化钡溶液 | 产生白色沉淀 | K2CO3+BaCl2=BaCO3↓+2KCl 反应的基本类型为复分解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
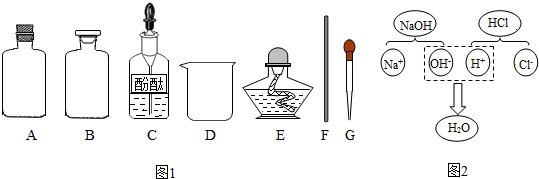
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入铁锈粉末 | 红棕色粉末逐渐减少,溶液变成黄色 | 稀盐酸过量 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com