
科目: 来源: 题型:解答题
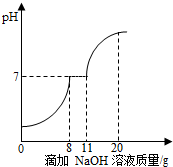 在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),同学们做了如下实验:取10g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系.
在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),同学们做了如下实验:取10g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验步骤和现象 | 结论 |
| 取无色溶液少许于试管中,向其中加入过量的氯化钙溶液,有白色沉淀产生,过滤,再向滤液中加入无色酚酞试液,溶液变红 | 猜想Ⅲ成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 海水密度/(g•mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 物 质 | 选用试剂 | 操作 |
| A | CO2(CO) | O2 | 点燃 |
| B | NaOH溶液(Na2CO3) | 稀盐酸 | 加入试剂至不再产生气泡 |
| C | KNO3溶液(KOH) | Cu(NO3)2溶液 | 加入适量的试剂,直接蒸发 |
| D | CaCl2溶液(HCl) | 过量CaCO3 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6克 | B. | 10克 | C. | 7.8克 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com