
科目: 来源: 题型:解答题
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 溶液不变红色 | 猜想一不正确 |
| 方案二 | 取少量烧杯内的溶液于试管中,逐滴加入碳酸钠溶液至过量 | 溶液变红色 | 猜想二不正确猜想三正确 |
查看答案和解析>>
科目: 来源: 题型:解答题
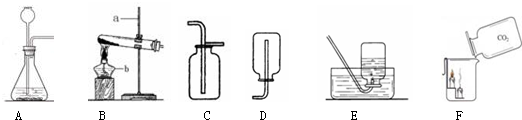
查看答案和解析>>
科目: 来源: 题型:填空题
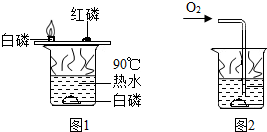 小明用图1所示装置探究可燃物燃烧的条件.他发现热水中的白磷熔化成一白色小液滴.不久,铜片的白磷开始燃烧,而红磷和水中的白磷都不燃烧.请回答:
小明用图1所示装置探究可燃物燃烧的条件.他发现热水中的白磷熔化成一白色小液滴.不久,铜片的白磷开始燃烧,而红磷和水中的白磷都不燃烧.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
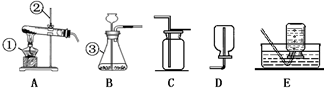
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
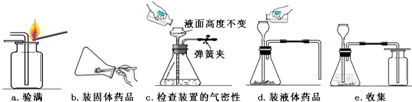
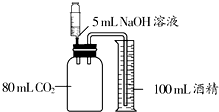 下列三个实验均可证明CO2能与NaOH溶液反应.
下列三个实验均可证明CO2能与NaOH溶液反应.查看答案和解析>>
科目: 来源: 题型:解答题
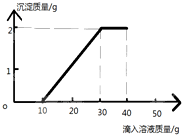 某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取62.44g该混合溶液于烧杯中,向烧杯中滴入溶质质量分数为13.8%K2CO3溶液40克.滴入K2CO3溶液质量与生成沉淀质量的关系如图所示.求:
某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取62.44g该混合溶液于烧杯中,向烧杯中滴入溶质质量分数为13.8%K2CO3溶液40克.滴入K2CO3溶液质量与生成沉淀质量的关系如图所示.求:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
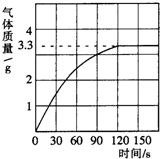 我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.
我校科学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,收集12.5g水垢,将足量的质量分数为10%的盐酸加入到水垢中,产生CO2气体的情况如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
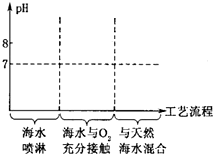 为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:
为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com