
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
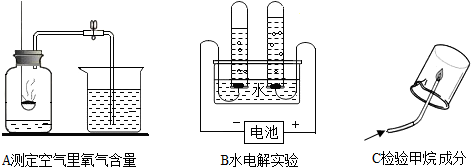
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 碳酸钠溶液 | 产生气泡 | 证明研究结论正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
| 实验步骤 | 实验现象 | 实验结论 |
用试管取无色溶液少许,加入过量的氯化钙溶液,再滴加适量的酚酞试液 | 酚酞试液变红色 | 无色溶液中确实 含有氢氧化钠 |
查看答案和解析>>
科目: 来源: 题型:解答题
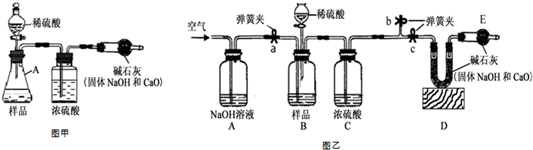
查看答案和解析>>
科目: 来源: 题型:解答题
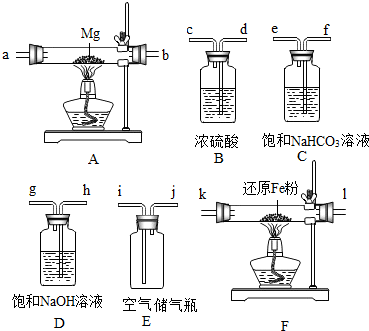
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 17 | m | 6 | 11 |
| A. | 该反应的化学方程式为:3X+Y=2Z+W | B. | 该反应的基本类型为化合反应 | ||
| C. | Y在反应中可能起催化作用 | D. | 反应后容器中Z与Y的质量比为6:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuO | B. | Cu | C. | Fe | D. | Cu和Fe |
查看答案和解析>>
科目: 来源: 题型:解答题
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
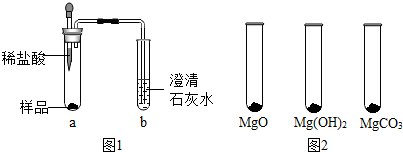
查看答案和解析>>
科目: 来源: 题型:解答题
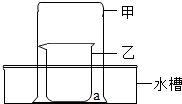 某化学兴趣小组用如图所示装置研究以下两个问题.
某化学兴趣小组用如图所示装置研究以下两个问题.查看答案和解析>>
科目: 来源: 题型:解答题
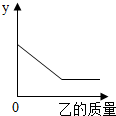 甲为初中化学常见物质,请根据下列叙述回答问题.
甲为初中化学常见物质,请根据下列叙述回答问题.| 甲 | 乙 | y轴含义 | |
| A | 生石灰 | 水 | 固体质量 |
| B | 铜锌合金粉末 | 硫酸铜溶液 | 溶液质量 |
| C | 工业炼铁的尾气 | 氢氧化钠溶液 | 气体质量 |
| D | 密闭容器中的空气 | 红磷 | 反应过程中容器内压强 |
查看答案和解析>>
科目: 来源: 题型:解答题
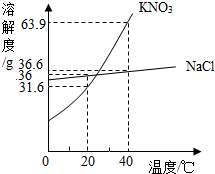 水和溶液与人类生存和发展密切相关.
水和溶液与人类生存和发展密切相关.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com