
科目: 来源: 题型:解答题
 某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:
某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:| 物质的质量 | |
| 反应前:烧杯+盐酸 | 22g |
| 10片钙片 | 8g |
| 反应后:烧杯+剩余物 | 26.7g |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | ① | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | ② |
查看答案和解析>>
科目: 来源: 题型:解答题
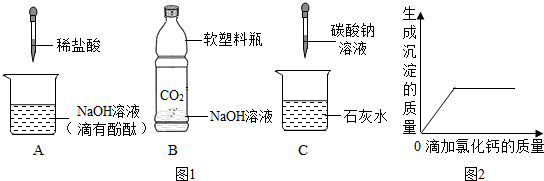
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 化学反应事实 | 影响反应的因素 |
| A | 过氧化氢遇二氧化锰后迅速分解,水遇二氧化锰不分解 | 催化剂 |
| B | 镁与盐酸反应生成氢气,铜与盐酸不反应 | 反应物的种类 |
| C | 碳在常温下不与氧气反应,在点燃时能与氧气反应 | 反应的温度 |
| D | 红热的铁丝在空气中很难燃烧,在氧气中能剧烈燃烧 | 反应物的浓度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 据中国室内装饰协会调查,甲醛污染大部分是由板材产生,家庭装修中使用的夹芯板、地板、家具等都可能释放出甲醛.我国的国家检测标准:“El级板材相当于甲醛释放量为1.5mg/L;E0级板材的甲醛释放量为0.5mg/L.”E1级与E0级最大的区别就是甲醛的释放量,El级比E0级释放甲醛量多五分之一.目前,化学家已能从马铃薯中提取植物胶做板材的黏合剂,有效地减少了甲醛的排放.试根据上述资料填空:
据中国室内装饰协会调查,甲醛污染大部分是由板材产生,家庭装修中使用的夹芯板、地板、家具等都可能释放出甲醛.我国的国家检测标准:“El级板材相当于甲醛释放量为1.5mg/L;E0级板材的甲醛释放量为0.5mg/L.”E1级与E0级最大的区别就是甲醛的释放量,El级比E0级释放甲醛量多五分之一.目前,化学家已能从马铃薯中提取植物胶做板材的黏合剂,有效地减少了甲醛的排放.试根据上述资料填空:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaH2 | B. | H2O | C. | Ca(OH)2 | D. | H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com