
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
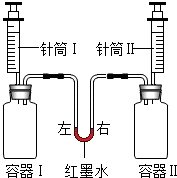 如图所示进行实验,同时将针筒内全部液体迅速注入容器中.实验内容如下表所示.
如图所示进行实验,同时将针筒内全部液体迅速注入容器中.实验内容如下表所示.| 实验 编号 | 容器I | 针筒I | 容器Ⅱ | 针筒Ⅱ | 红墨水 液面位置 |
| a | 10mL 水 | NaCl | 10mL 水 | 保持 左高右低 | |
| b | 二氧化碳 (充满) | 10mL 澄清石灰水 | 二氧化碳 (充满) | 10mlL浓氢氧化钠溶液 | |
| c | 1g锌 | 15mL盐酸 | 1g镁 | 15mL盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)李丽同学设计了实验室制取CO2的装置(如图所示),装置中出现了一个错误,你的纠正方法是用向上排空气法收集CO2.
(1)李丽同学设计了实验室制取CO2的装置(如图所示),装置中出现了一个错误,你的纠正方法是用向上排空气法收集CO2.查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 一段时间后的质量(g) | 17 | m | 6 | 11 |
查看答案和解析>>
科目: 来源: 题型:解答题
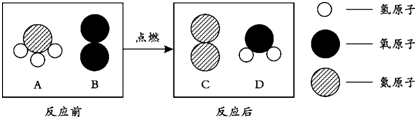
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO和CO2的组成元素相同,所以它们的化学性质相同 | |
| B. | 化学变化伴随有能量变化,所以有能量变化的一定是化学变化 | |
| C. | 氧化物都含有氧元素,所以,含有氧元素的都是氧化物 | |
| D. | 化合物都是由不同种元素组成的,所以不同种元素组成的纯净物一定是化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
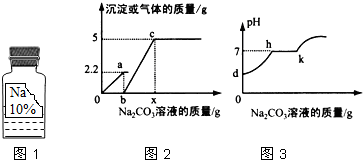 实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加氢氧化钙溶液 | 白色浑浊 | 猜想②正确 相关的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com