
科目: 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧时火星四射,有黑色四氧化三铁固体生成 | |
| B. | 铁钉与稀盐酸反应后溶液由无色变成了蓝色 | |
| C. | 硫在空气中燃烧发出微弱的淡蓝色火焰 | |
| D. | 红磷在空气中燃烧,冒大量的白雾 |
查看答案和解析>>
科目: 来源: 题型:解答题
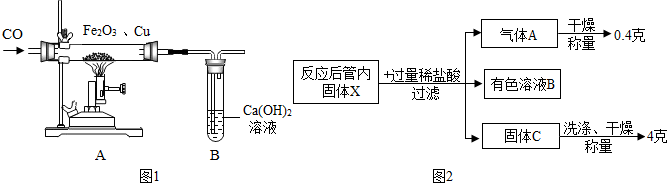
查看答案和解析>>
科目: 来源: 题型:解答题
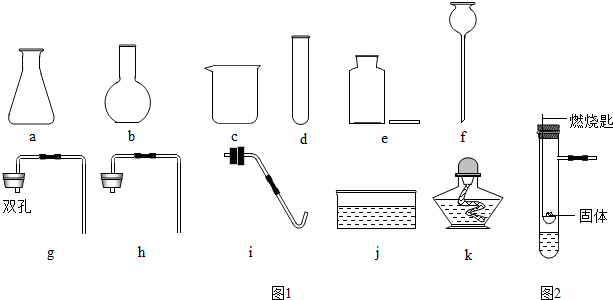
查看答案和解析>>
科目: 来源: 题型:解答题
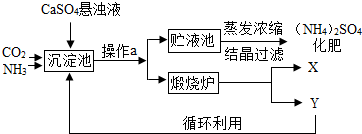 某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽油挥发--分子体积变大 | |
| B. | 酒香不怕巷子深--分子在不断运动 | |
| C. | 向篮球中打气--分子间有间隔 | |
| D. | 氧化汞分解成汞和氧气--化学变化中分子可分 |
查看答案和解析>>
科目: 来源: 题型:解答题
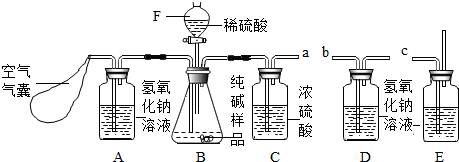
查看答案和解析>>
科目: 来源: 题型:解答题
 草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如图所示.请回答下列问题:
草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如图所示.请回答下列问题:| 同学 | 实验操作 | 实验现象 | 结论 |
| 小强 | 取少量固体放入烧杯中,加适量水并搅拌 | 烧杯发热 | 剩余固体中一定含有CaO(或氧化钙). 一定不含有CaC2O4. |
| 小明 | 另取少量固体放入试管中,加足量稀盐酸 | 有气体产生 | 剩余固体中一定含有CaCO3(或碳酸钙). |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com