
科目: 来源: 题型:选择题
| A. | 5个钠离子--5 $\stackrel{+1}{Na}$ | B. | 2个氧原子--O2 | ||
| C. | 1个氮气分子--N2 | D. | 硫酸铁--FeSO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.1g | B. | 1.5 g | C. | 1.05 g | D. | 0.6g |
查看答案和解析>>
科目: 来源: 题型:解答题
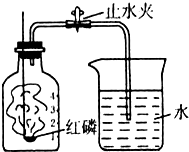 某同学在学习了拉瓦锡测空气中氧气含量的测定方法后,自己设计如图所示的装置,用来测空气中氧气的含量.该同学的实验步骤如下:
某同学在学习了拉瓦锡测空气中氧气含量的测定方法后,自己设计如图所示的装置,用来测空气中氧气的含量.该同学的实验步骤如下:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
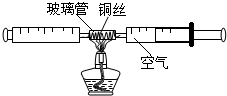 在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 25mL | 22mL |
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com