
科目: 来源: 题型:解答题
 小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 称取5.0g氯化钾,溶解在95mL水中,充分搅拌 | |
| B. | 量取5.0mL过氧化氢溶液,放入入95mL水中,充分搅拌 | |
| C. | 量取5.0mL浓盐酸,倒入95mL水中,充分搅拌 | |
| D. | 称取5.0g碳酸钙,放入95mL水中,充分搅拌 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 提出问题,白色固体是什么 | 实验操作 | 实验现象 | 实验结论 |
| 白色固体是氢氧化钙 | 将固体加入足量水中溶解,过滤,在滤液中加入Na2CO3溶液(不能用酸碱指示剂) | 产生白色沉淀 | 猜想成立 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钠溶液反应前后溶液的总质量不变 | |
| B. | 氢氧化钠溶液与稀盐酸反应前后溶液中的溶质总质量减少了 | |
| C. | 一氧化碳还原氧化铜的反应前后固体总质量不变 | |
| D. | 硫酸与碳酸钠溶液反应前后溶液中的溶剂总质量不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
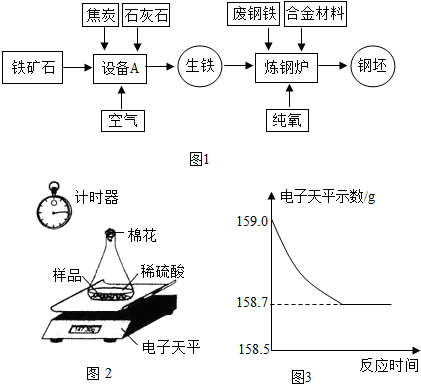
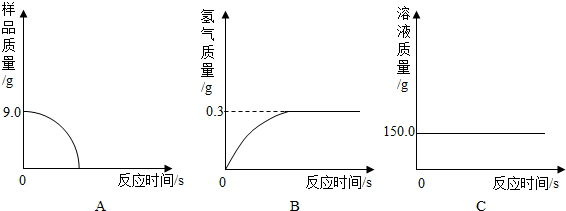
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
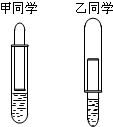 有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.
有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸.甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气.那么其中乙学生设计的装置比较合理.用较合理的装置制取氢气时,要使氢气充满收集氢气的试管,在不增减仪器的条件下,应该采取的措施是先将小试管贴近大试管底部,随着气泡的生成,慢慢将小试管向下降或将大试管向上升高.查看答案和解析>>
科目: 来源: 题型:填空题
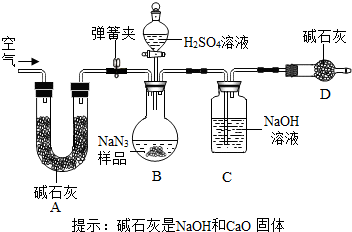 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com