
科目: 来源: 题型:选择题
| A. | 砍伐竹子、烧炭、竹炭净化室内空气都属于物理变化 | |
| B. | 竹炭纤维中C、H、O三种元素的质量比为 12:1:16 | |
| C. | 竹炭纤维分子中的C、H、O原子个数比为6:10:5 | |
| D. | 每个(C6H10O5)n分子中含有5n个H2O分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 被测植物 | 平均伤斑面积(%) |
| 甲 | 13.5 |
| 乙 | 33.4 |
| 丙 | 57.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 刷墙所用的石灰乳属于溶液,其溶质是氢氧化钙 | |
| B. | 氢氧化钙俗称熟石灰,受热分解可得到生石灰 | |
| C. | 一段时间后,墙面表层物质的PH比其内层物质的PH大 | |
| D. | 为了验证碳酸盐的生成,可用稀盐酸,澄清石灰水进行检验 |
查看答案和解析>>
科目: 来源: 题型:解答题
 碳酸钠俗称纯碱,暴露在空气中可与空气中的二氧化碳、水发生反应:Na2CO3+CO2+H2O═2NaHCO3.有一瓶久置的碳酸钠(其中含有碳酸氢钠),为了测定其中碳酸钠的质量分数,设计了如下实验方案.
碳酸钠俗称纯碱,暴露在空气中可与空气中的二氧化碳、水发生反应:Na2CO3+CO2+H2O═2NaHCO3.有一瓶久置的碳酸钠(其中含有碳酸氢钠),为了测定其中碳酸钠的质量分数,设计了如下实验方案.查看答案和解析>>
科目: 来源: 题型:解答题
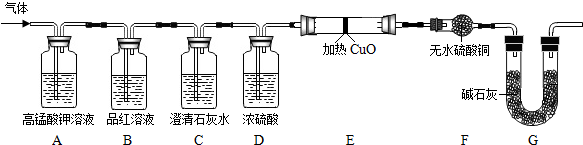
| 实验过程 | 实验现象 | 实验结论 |
| 1°气体通过高锰酸钾溶液. | 高锰酸钾溶液褪色. | 猜想4成立 |
| 2°气体通过澄清石灰水. | 澄清石灰水变浑浊. | |
| 3°气体通过氧化铜和无水硫酸铜. | 黑色氧化铜变红色,无水硫酸铜变蓝色(合理即可). |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 剩余固体不含高锰酸钾 | |
| B. | 剩余固体含有高锰酸钾 | |
| C. | 剩余固体与原高锰酸钾的质量比为71:79 | |
| D. | 剩余固体与原高锰酸钾的质量比大于71:79 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.
已知:白色Fe(OH)2很容易被空气中的氧气氧化为Fe(OH)3,Fe(0H)3为红褐色沉淀,用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 若用排空气法收集CO2(密度比空气大)时,气体应从A端通入 | |
| B. | 若用排空气法收集氧气时,气体从B端通入 | |
| C. | 若用排空气法收集H2时,气体应从A端通入 | |
| D. | 若用水将此装置中的O2排出,水应从B端进入 |
查看答案和解析>>
科目: 来源: 题型:解答题
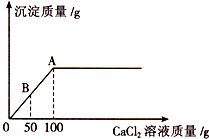 五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.
五一节后,小丽带着愉快的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望.| 阴离子 阳离子 | 0H- | N03- | C1- | C032- |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 溶 | 不溶 |
| Cu2+ | 不溶 | 溶 | 溶 | 不溶 |
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液 | 产生白色沉淀,溶液变红 | NaOH溶液部分变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com