
科目: 来源: 题型:解答题
 (1)材料是人类赖以生存和发展的重要物质基础.
(1)材料是人类赖以生存和发展的重要物质基础.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 17克 | B. | 18克 | C. | 19克 | D. | 22克 |
查看答案和解析>>
科目: 来源: 题型:解答题
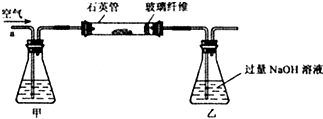
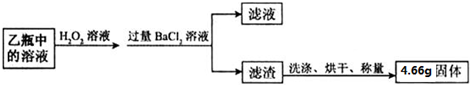
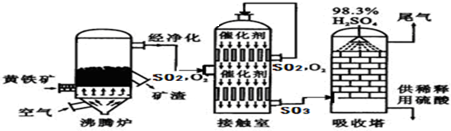
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
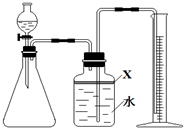 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 2:5 | D. | 4:5 |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 甲不可能是KCl | B. | 丙不一定是Ca(OH)2 | C. | 乙可能是HCl | D. | 丁一定是Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
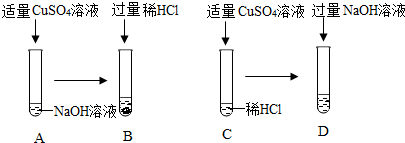
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com