
科目: 来源: 题型:解答题
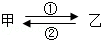 甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.
甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
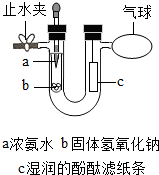 某同学在学完《分子和原子》后,对教材中的实验进行了如图改进:
某同学在学完《分子和原子》后,对教材中的实验进行了如图改进:查看答案和解析>>
科目: 来源: 题型:解答题
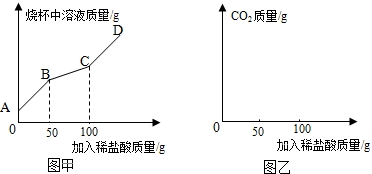
 某化学兴趣小组利用如下装置探究两个实验.
某化学兴趣小组利用如下装置探究两个实验.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  向一定量PH=3的盐酸溶液中不断加水稀释 | |
| B. |  温度不变时,向一定量的饱和石灰水中不断加入生石灰 | |
| C. |  向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量 | |
| D. |  将一定质量的红磷放在盛有氧气的密闭容器中加热至燃烧 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | XY2 | B. | X2Y | C. | XY3 | D. | X2Y3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com