
科目: 来源: 题型:填空题
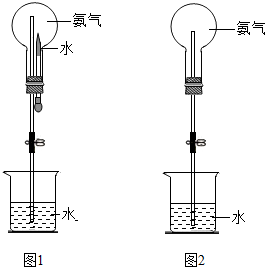 我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:
我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:查看答案和解析>>
科目: 来源: 题型:填空题
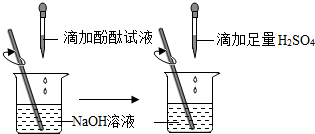
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
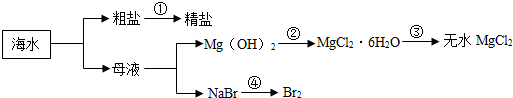
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:NaOH溶液、Na2CO3溶液、BaCl2溶液,过滤后加盐酸 | |
| B. | 第②步中加入的试剂为CaCl2溶液 | |
| C. | 第③步中发生氧化还原反应 | |
| D. | 在第④步中溴元素被还氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天平指针开始偏向放铁粉的烧杯一边 | |
| B. | 两只烧杯最终可能有一只烧杯有金属剩余 | |
| C. | 天平指针最终偏向放铁粉的烧杯一边 | |
| D. | 天平最终平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 连二亚硫酸钠与水能剧烈反应,化学性质很活泼 | |
| B. | 连二亚硫酸钠是一种盐,硫元素化合价为+6价 | |
| C. | 连二亚硫酸钠俗称“保险粉”,原因是化学性质很稳定 | |
| D. | 连二亚硫酸钠俗称“保险粉”,无须密封保存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0个 | B. | l个 | C. | 2个 | D. | 3个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 取0.5gCaCO3粉末于试管中,加入过量稀盐酸,充分振荡,粉末消失且有气泡产生 | |
| B. | 取0.5gCaCO3粉末于试管中,加入过量硫酸,充分振荡后,产生少许气泡,粉末未消失 | |
| C. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴入酚酞试液,立即变红 | |
| D. | 取0.5gCaCO3粉末于试管中,加入3mL蒸馏水,充分振荡后,滴加10%NaOH溶液,无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{a}{2b}$ | B. | $\frac{a}{2(a+b)}$ | C. | $\frac{a}{b}$ | D. | $\frac{a}{(a+2b)}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 检测小组 | 检测结果 |
| 甲组 | KCl、FeCl3、KOH、HCl |
| 乙组 | NaCl、Ca(NO3)2、K2CO3、HCl |
| 丙组 | NaCl、Mg(NO3)2、K2SO4、H2SO4 |
| 丁组 | KCl、KNO3、K2CO3、KOH |
| A. | 甲组、乙组 | B. | 丙组、丁组 | C. | 甲组、丙组 | D. | 乙组、丁组 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com