
科目: 来源: 题型:解答题


| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
查看答案和解析>>
科目: 来源: 题型:选择题
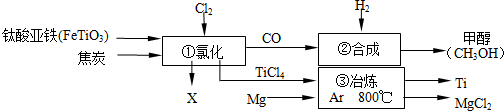
| A. | 钛酸亚铁(FeTiO3)中钛元素为+4价 | |
| B. | ①中反应为:2FeTiO3+6C+7Cl2═2X+2TiCl4+6CO,则X为FeCl3 | |
| C. | ③中氩气(Ar)作保护气,反应类型为置换反应 | |
| D. | ②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
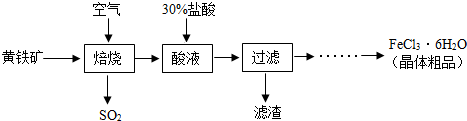
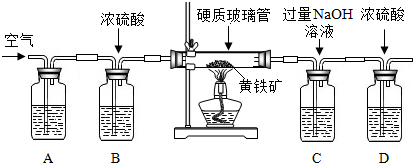
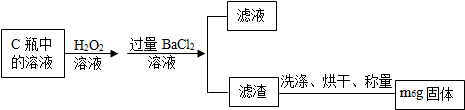
查看答案和解析>>
科目: 来源: 题型:解答题
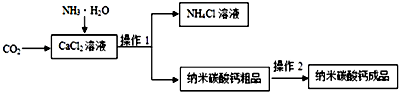
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用熟石灰区分氯化铵和氯化钾 | |
| B. | 用水区分硝酸铵和蔗糖固体 | |
| C. | 用稀硫酸溶液区分黄铜(Cu、Zn)和黄金 | |
| D. | 用硝酸钡区分稀硫酸和硫酸钠溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧气约占空气总体积的$\frac{1}{5}$ | |
| B. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要 | |
| C. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| D. | 夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4:1 | B. | 2:3 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com