
科目: 来源: 题型:解答题
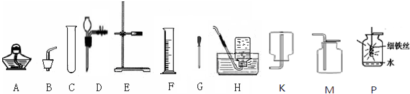
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
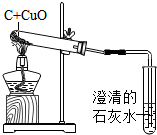 某中学化学兴趣小组按照课本实验方法,做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现.他们决定对这个实验进行探究和改进.
某中学化学兴趣小组按照课本实验方法,做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现.他们决定对这个实验进行探究和改进.查看答案和解析>>
科目: 来源: 题型:解答题
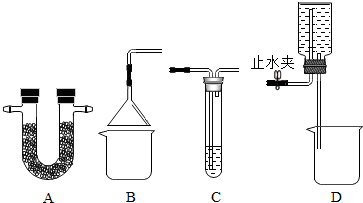
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是某试剂瓶标签的部分内容.请回答下列问题:
如图是某试剂瓶标签的部分内容.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢 |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量 Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用食盐腌制鱼、肉,可以延长鱼、肉的保存期 | |
| B. | 用燃着的火柴检查液化石油气是否泄漏 | |
| C. | 切完菜后将菜刀洗净擦干,放在干燥的地方 | |
| D. | 用食醋除去热水瓶中的水垢(主要成分是碳酸钙和氢氧化镁) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 密度(克/厘米3) | 1.07 | 1.14 | 1.30 | 1.50 | 1.73 | 1.84 |
| 溶质质量分数(%) | 10 | 20 | 40 | 60 | 80 | 98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com