
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量的稀盐酸,塞上带导管的单孔塞,把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
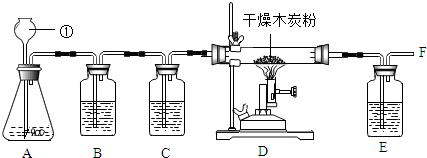
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
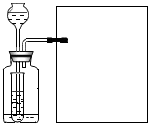 实验室常用硫化亚铁(FeS)与稀H2SO4发生复分解反应制取硫化氢气体.硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,它能溶于水,密度比空气大,其水溶液叫氢硫酸.某学生要在实验室中制取硫化氢气体,多余的硫化氢气体要进行处理.
实验室常用硫化亚铁(FeS)与稀H2SO4发生复分解反应制取硫化氢气体.硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,它能溶于水,密度比空气大,其水溶液叫氢硫酸.某学生要在实验室中制取硫化氢气体,多余的硫化氢气体要进行处理.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
| 实验操作 |  | 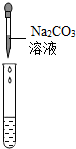 | 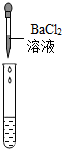 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有产生气泡 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
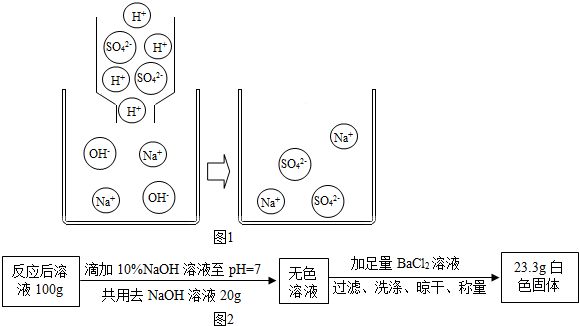
查看答案和解析>>
科目: 来源: 题型:解答题
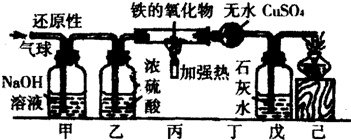
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com