
科目: 来源: 题型:选择题
| 试剂1 | 试剂2 温度/℃ | 溶解后 温度/℃ | 静置后 温度/℃ | 试剂3 温度/℃ | 混合后 温度/℃ |
| 0.5gNa2CO3 | 10mL H2O 20.0 | 23.3 | 20.0 | 10mL HCl(20%) 20.0 | 23.7 |
| 0.5gNaHCO3 | 10mL H2O 20.0 | 18.5 | 20.0 | 10mL HCl(20%) 20.0 | 20.8 |
| A. | Na2CO3在溶于水的过程中吸收热量 | |
| B. | NaHCO3在溶于水的过程中放出热量 | |
| C. | 其它条件相同时,碳酸氢钠溶液与盐酸混合过程中放出的热量比碳酸钠多 | |
| D. | 实验中,若同一列试剂的温度及所取的量不同,则实验结论的可信度降低 |
查看答案和解析>>
科目: 来源: 题型:解答题
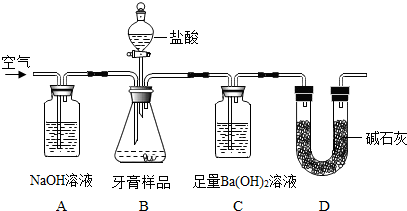
| 实验次数 | 样品质量(g) | 所用盐酸质量(g) | 所得沉淀质量(g) |
| 第一次 | 8.00 | 50 | 1.95 |
| 第二次 | 8.00 | 50 | 1.98 |
| 第三次 | 8.00 | 50 | 1.96 |
查看答案和解析>>
科目: 来源: 题型:解答题
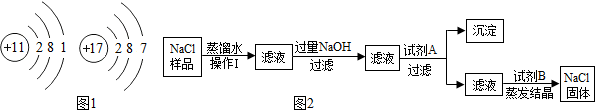
查看答案和解析>>
科目: 来源: 题型:解答题
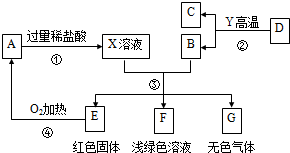
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 能源与环境问题是当今社会备受关注的热点.
能源与环境问题是当今社会备受关注的热点.查看答案和解析>>
科目: 来源: 题型:解答题
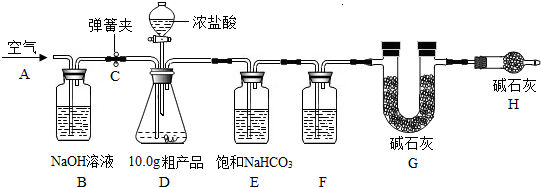
查看答案和解析>>
科目: 来源: 题型:填空题
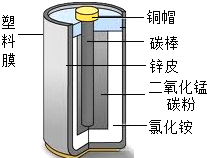 (1)物质分类:她将如图电池中各物质进行分类,其中属于氧化物的是二氧化锰、有机合成材料的是塑料膜、可回收的金属材料是锌、铜.
(1)物质分类:她将如图电池中各物质进行分类,其中属于氧化物的是二氧化锰、有机合成材料的是塑料膜、可回收的金属材料是锌、铜.查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | O | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | O.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com