
科目: 来源: 题型:解答题
 如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:
如图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 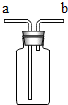 如图装置既可以收集气体,又可以干燥气体 | |
| B. | 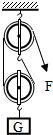 如图装置既可以省力,又可以改变力的方向 | |
| C. |  如图生物既可以光合作用,又可以呼吸作用 | |
| D. | 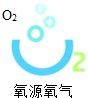 如图气体既可以助燃,又可以燃烧 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 一定质量的细铁丝(假设不含不杂质)在氧气中完全燃烧后生成四氧化三铁.固体的质量随时间的变化关系如图所示,试计算:
一定质量的细铁丝(假设不含不杂质)在氧气中完全燃烧后生成四氧化三铁.固体的质量随时间的变化关系如图所示,试计算:查看答案和解析>>
科目: 来源: 题型:解答题
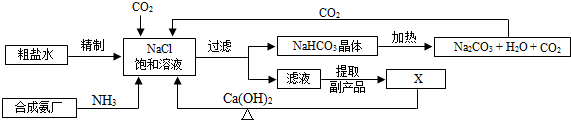
查看答案和解析>>
科目: 来源: 题型:解答题
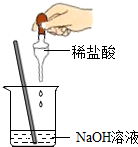 酸与碱作用生成盐和水的反应叫做中和反应,探究中和反应是否发生或酸和碱是否恰好完全反应的方法有多种.某学习小组的同学从不同角度进行有关中和反应的实验探究:
酸与碱作用生成盐和水的反应叫做中和反应,探究中和反应是否发生或酸和碱是否恰好完全反应的方法有多种.某学习小组的同学从不同角度进行有关中和反应的实验探究:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 实验内容和步骤 | 实验现象 |
| ①观察水样 | 浅黄色 |
| ②取少量水样,滴加过量的稀硝酸和硝酸钡溶液 | 有白色沉淀产生 |
| ③另取少量水样,用pH试纸检测 | pH=3 |
查看答案和解析>>
科目: 来源: 题型:选择题
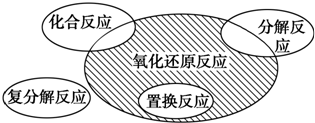
| A. | Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe+3CO2 | B. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH为3的盐酸溶液加水稀释,可以配成pH为2的盐酸溶液 | |
| B. | 氧化物一定含有氧元素,但含氧元素的物质不一定都是氧化物 | |
| C. | 固体氢氧化钠需密封保存是为了避免它与空气中的水蒸气发生化学反应而潮解 | |
| D. | 酸、碱、盐在水溶液里都可以离解成自由移动的离子,如氢氧化铁可以使紫色石蕊变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com