
科目: 来源: 题型:解答题
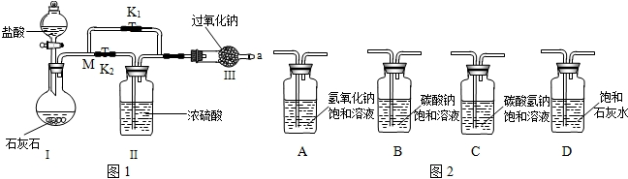
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20℃时,10g某物质溶解在100g水中,故该物质20℃时的溶解度为$\frac{10g}{100g}$水 | |
| B. | 20℃时,把10g某物质溶解在水中制成饱和溶液,故20℃时,该物质的溶解度为$\frac{10g}{100g}$水 | |
| C. | 10g某物质溶解在100g水中达到饱和状态,这种物质的溶解度为$\frac{10g}{100g}$水 | |
| D. | 20℃时,10g某物质溶解在100g水中达到饱和状态,故该物质在20℃的溶解度为$\frac{10g}{100g}$水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
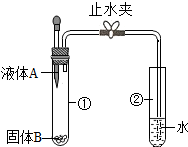 如图所示,打开止水夹,将液体A滴入试管①中,液体A与固体B接触,若在试管②中的导管口处没有气泡冒出,则下列液体A和固体B的组合可能是( )
如图所示,打开止水夹,将液体A滴入试管①中,液体A与固体B接触,若在试管②中的导管口处没有气泡冒出,则下列液体A和固体B的组合可能是( )| A. | 水和氢氧化钠 | B. | 稀盐酸和铁 | C. | 水和生石灰 | D. | 水和硝酸铵 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | ④ |
查看答案和解析>>
科目: 来源: 题型:解答题
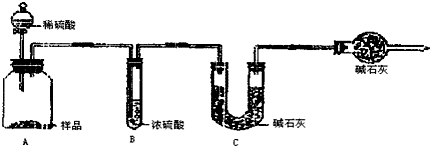
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
查看答案和解析>>
科目: 来源: 题型:解答题
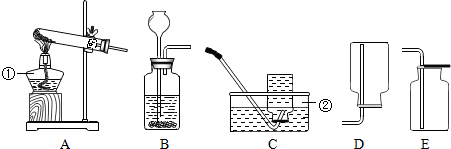
查看答案和解析>>
科目: 来源: 题型:解答题
 我国蕴藏着丰富的海洋资源,而淡水资源短缺,需要合理利用,爱护水资源.
我国蕴藏着丰富的海洋资源,而淡水资源短缺,需要合理利用,爱护水资源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com