
科目: 来源: 题型:选择题
| A. | 在化学变化中,分子可分,原子不可分 | |
| B. | 钠原子失去1个电子形成钠离子 | |
| C. | 水分子由氢分子和氧分子组成 | |
| D. | 构成物质的微粒是在不停地运动 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 肥皂水 | 雨水 | 糖水 | 柠檬汁 | 洗洁精 |
| pH | 10.2 | 5.2 | 7.0 | 2.5 | 12.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 打开装有浓盐酸的试剂瓶盖,瓶口处有白烟出现 | |
| B. | 盐酸遇石蕊试液变成红色 | |
| C. | 某无色溶液能使紫色石蕊试液变蓝,则该溶液能使酚酞试液变成红色 | |
| D. | 能使石蕊试液变红的溶液一定是酸的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 托盘天平、烧杯、玻璃棒、量筒 | B. | 托盘天平、烧坏、玻璃棒、药匙 | ||
| C. | 烧杯、量筒、玻璃棒、胶头滴管 | D. | 酒精灯、烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目: 来源: 题型:解答题
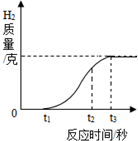 铝箔是现代生活中常见的包装材料,放置久了其银白色光泽会变暗淡,故又称假银箔.小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示.反应停止时,铝箔还有大量剩余.请你解释0~t1、t2~t3段氢气质量随时间变化的原因.
铝箔是现代生活中常见的包装材料,放置久了其银白色光泽会变暗淡,故又称假银箔.小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示.反应停止时,铝箔还有大量剩余.请你解释0~t1、t2~t3段氢气质量随时间变化的原因.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
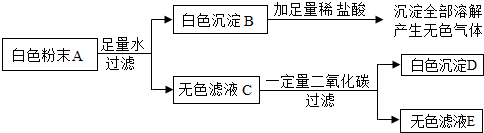
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com