
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:选择题
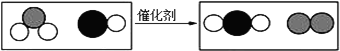
| A. | 分子在化学变化中不可分 | B. | 原子在化学变化中可分 | ||
| C. | 分子是由原子构成的 | D. | 原子比分子一定小 |
查看答案和解析>>
科目: 来源: 题型:解答题
 雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了PH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了PH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:查看答案和解析>>
科目: 来源: 题型:解答题
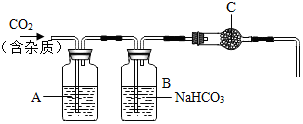 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.刘亮同学用这种大理石和稀盐酸反应制取二氧化碳.因为考虑有硫化钙,刘亮还查阅了相关的资料,开展了深入的探究.| 溶质 | H2SO4 | HCl | H2S | HClO |
| pH | 小→大 | |||
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
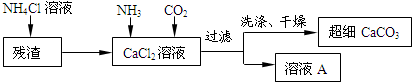
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com