
科目: 来源: 题型:选择题
| A. | 红磷点燃后伸入氧气中产生大量白雾 | |
| B. | 铁丝伸入氧气中火星四射 | |
| C. | 硫粉在氧气中燃烧产生明亮蓝紫色火焰 | |
| D. | 能加快反应速度而自身的化学性质和质量均不发生改变的物质叫催化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A.物质的分类 | B.资源的利用和保护 |
| ①氧化物-一定含有氧元素 ②混合物-一定含有多种元素 | ①保护空气一减少有害气体和烟尘的排放 ②爱护水资源一节约用水和防止水体污染 |
| C.性质与用途 | D.用“化学”眼光分析 |
| ①石墨能导电--作铅笔芯 ②活性炭有吸附性--作冰箱除臭剂 | ①湿衣服晾干一分子之间有间隔 ②明矾净水一明矾溶于水生成胶状物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

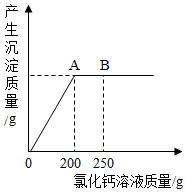
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

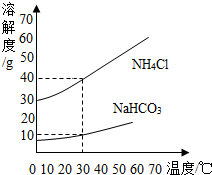
查看答案和解析>>
科目: 来源: 题型:解答题
 小明欲通过化学实验证明“质量守恒定律”,确定以“稀盐酸与碳酸氢钠反应”为研究对象,设计的实验装置如图所示.化学反应前烧杯里有50g稀盐酸,试管里有2g碳酸氢钠粉末;化学反应时将碳酸氢钠粉末倒入稀盐酸,试管再放回烧杯.
小明欲通过化学实验证明“质量守恒定律”,确定以“稀盐酸与碳酸氢钠反应”为研究对象,设计的实验装置如图所示.化学反应前烧杯里有50g稀盐酸,试管里有2g碳酸氢钠粉末;化学反应时将碳酸氢钠粉末倒入稀盐酸,试管再放回烧杯.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 15 g | B. | 18g | C. | 20g | D. | 30 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com