
科目: 来源: 题型:解答题
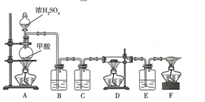 某同学用如图所示装置制取纯净、干燥的CO,并进行相关实验.资料:
某同学用如图所示装置制取纯净、干燥的CO,并进行相关实验.资料:| 样品质量 | 装置D中玻璃管和固体的总质量 | 装置E的质量 |
| 2.32g | 反应前55.72g | 反应前281.00g |
| 反应后55.08g | 反应后281.56g |
查看答案和解析>>
科目: 来源: 题型:解答题
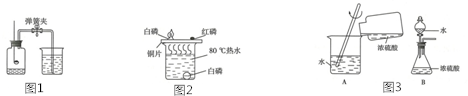
查看答案和解析>>
科目: 来源: 题型:选择题
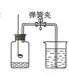 如图所示装置可用来测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号,对该实验认识正确的是( )
如图所示装置可用来测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号,对该实验认识正确的是( )| A. | 使用红磷的量多或少,都不会影响实验结果 | |
| B. | 该实验也可以用硫粉或铁丝代替红磷进行燃烧 | |
| C. | 点燃红磷前先用弹簧夹夹紧乳胶管 | |
| D. | 红磷熄灭后立即打开弹簧夹,观察现象并记录进入的水的体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为了节约药品,实验后剩余的药品应立即放回原瓶 | |
| B. | 稀释浓硫酸时,将水沿烧杯内壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌 | |
| C. | 浓碱溶液沾到皮肤上,应立即用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 过滤时,要将液体沿玻璃棒慢慢向漏斗中倾倒 |
查看答案和解析>>
科目: 来源: 题型:解答题
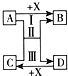 A、B、C、D、X为初中常见的五种物质,请根据要求回答问题.
A、B、C、D、X为初中常见的五种物质,请根据要求回答问题.查看答案和解析>>
科目: 来源: 题型:解答题

| 编号 | KC103 质量/g | 其他物质质量/g | 待测数据 |
| 实验1 | 2.0 | / | |
| 实验2 | a | Mn02 0.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
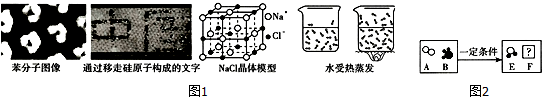
| A | B | C | D | |
| 微观示意图 |  |  |  |  |
| 化学符号 | 2O2 | 3NH3 | ? | / |
查看答案和解析>>
科目: 来源: 题型:解答题
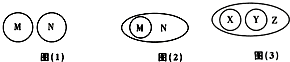
| 选项 | M | N |
| A | 单质 | 化合物 |
| B | 酸 | 纯净物 |
| C | 有机物 | 无机物 |
| D | 化学反应 | 置换反应 |
| E | 中和反应 | 复分解反应 |
| F | 氧化反应 | 化合反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
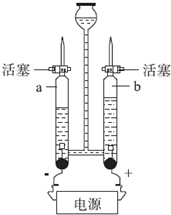 (1)如图是1水的电解实验装置图.
(1)如图是1水的电解实验装置图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com