
科目: 来源: 题型:选择题
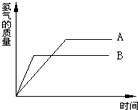 将等质量、颗粒大小相同的A、B两种金属分别同时投入到质量相等、溶质质量分数也相等的稀盐酸中,生成氢气的质量与时间的关系如图所示.已知两种金属在化合物中均显+2价,则下列说法不正确的是( )
将等质量、颗粒大小相同的A、B两种金属分别同时投入到质量相等、溶质质量分数也相等的稀盐酸中,生成氢气的质量与时间的关系如图所示.已知两种金属在化合物中均显+2价,则下列说法不正确的是( )| A. | 充分反应所需的时间:A>B | B. | 金属活动性:B>A | ||
| C. | 相对原子质量:A>B | D. | A、B可能分别是常见金属中的Fe、Zn |
查看答案和解析>>
科目: 来源: 题型:解答题
 【实验原理及实验方案设计】
【实验原理及实验方案设计】| 方案 | 实验操作 | 实验现象 | 结论 |
| 方案一 | 取少量滤液于试管中,在滤液中插入一根铁丝 | 铁丝表面有银白色固体析出 | 猜想②成立 |
| 铁丝表面无变化 | 猜想①成立 | ||
| 方案二 | 取少量滤液于试管中,滴加几 滴稀盐酸 | 生成白色沉淀 | 猜想②成立 |
| 滤液无明显变化 | 猜想①成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.| 实验操作 | 实验现象 | 实验结论 |
猜想二正确 |
查看答案和解析>>
科目: 来源: 题型:解答题




查看答案和解析>>
科目: 来源: 题型:解答题
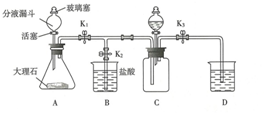
 某科学兴趣小组查阅资料得知镁可在氧气中燃烧生成氧化镁,可在氮气中燃烧生成氮化镁,于是设计了如下方案进行验证.步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置.另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条.
某科学兴趣小组查阅资料得知镁可在氧气中燃烧生成氧化镁,可在氮气中燃烧生成氮化镁,于是设计了如下方案进行验证.步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置.另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质与氧气发生的反应都是氧化反应 | |
| B. | 点燃氢气时发生爆炸,可能是因为没有检验氢气的纯度 | |
| C. | 铁生锈属于缓慢反应 | |
| D. | 凡是氧化反应都是化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com