
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:单选题
下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
A 【解析】A、四种离子间不能结合成沉淀、气体或水,能大量共存,正确。B、H+、CO32-两种离子能结合生成水和二氧化碳,不能大量共存,错误。C、Cu2+、OH-两种离子能结合生成氢氧化铜沉淀,不能大量共存,错误。D、OH-、NH4+两种离子能结合成生成水和氨气,不能大量共存,错误。故选A。归纳是学习化学常用的方法。下列归纳全部正确的是
A.操作顺序 | B.生活化学 |
①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
C.解释说明 | D.化学鉴别 |
①稀有气体作保护气,因为其化学性质稳定 | ①看颜色色鉴别羊毛纤维和棉纤维 |
A. A B. B C. C D. D
查看答案下列说法正确的是
A. 铜被广泛地运用于制造电线、电缆,因此铜是导电性最好的金属
B. 化学反应常常伴随着能量变化,因此有能量变化的都是化学反应
C. 盐酸、硫酸溶液中酸根离子不同,因此它们的化学性质存在差异
D. 某化肥加熟石灰研磨,没有嗅到氨味,因此该化肥一定不是氮肥
查看答案据报道,我国科学家发现一种氦钠化合物(化学式为Na2He)。下列说法正确的是( )
A. Na2He中Na为+1价,He为-1价 B. Na2He中Na、He元素的质量比为2:1
C. Na2He中含有金属元素和稀有气体元素 D. 稀有气体都很稳定,不与任何物质反应
查看答案选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数为10%的氯化钠溶液.下列说法正确的是( )
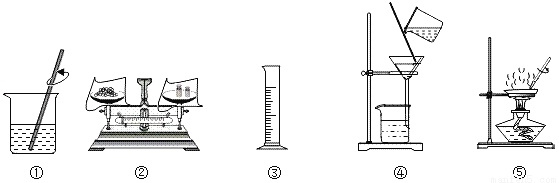
A. 操作①和⑤中玻璃棒的作用是相同的
B. 甲实验和乙实验都要用到的实验操作①
C. 甲实验在操作⑤时,将水全部蒸发后停止加热
D. 乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
查看答案化学与我们的生活 相关。以下说法正确的是
①为保护水资源应禁止使用化肥农药
②回收废旧金属有利于节约资源
③天然气泄漏应立即打开排气扇换气
④用聚氯乙烯塑料包装食品
⑤减少燃煤发电,增加太阳能发电,有利于治理雾霾
A.②⑤ B.②③⑤ C。④⑤ D.①③④
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:单选题
下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
C 【解析】A.铁锈和铁都能与硫酸反应,用过量的稀硫酸长时间浸泡,会把铁腐蚀;B.验证甲烷中含有H 元素,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴,甲烷是纯净物,不含氢气;C.鉴别化肥KNO3和NH4Cl,取样与熟石灰混合研磨,闻气味,氯化铵会因生成氨气产生刺激性气味;D.氢氧化钠和碳酸钠溶液都呈碱性,都能使酚酞试液变红;C下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
查看答案归纳是学习化学常用的方法。下列归纳全部正确的是
A.操作顺序 | B.生活化学 |
①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
C.解释说明 | D.化学鉴别 |
①稀有气体作保护气,因为其化学性质稳定 | ①看颜色色鉴别羊毛纤维和棉纤维 |
A. A B. B C. C D. D
查看答案下列说法正确的是
A. 铜被广泛地运用于制造电线、电缆,因此铜是导电性最好的金属
B. 化学反应常常伴随着能量变化,因此有能量变化的都是化学反应
C. 盐酸、硫酸溶液中酸根离子不同,因此它们的化学性质存在差异
D. 某化肥加熟石灰研磨,没有嗅到氨味,因此该化肥一定不是氮肥
查看答案据报道,我国科学家发现一种氦钠化合物(化学式为Na2He)。下列说法正确的是( )
A. Na2He中Na为+1价,He为-1价 B. Na2He中Na、He元素的质量比为2:1
C. Na2He中含有金属元素和稀有气体元素 D. 稀有气体都很稳定,不与任何物质反应
查看答案选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数为10%的氯化钠溶液.下列说法正确的是( )

A. 操作①和⑤中玻璃棒的作用是相同的
B. 甲实验和乙实验都要用到的实验操作①
C. 甲实验在操作⑤时,将水全部蒸发后停止加热
D. 乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:单选题
把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
B 【解析】试题分析:由反应关系图1可知:X、Y、Z、M四种金属,分别投入稀盐酸中时,只有X、Z有反应;说明X、Z的活泼性大于Y、M;又因为金属活动性越强的金属,与酸反应时速度越快,根据图象可以看出X与酸反应时快,所以可判断X的活动性大于Z,故选项A、D错误;从把X加入到Z(NO 3) 2溶液中,M加入到YNO 3溶液中,反应的关系图可以看出X能把Z置换出来,M能把Y置换出来,根据”在金属活...下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
查看答案下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
查看答案归纳是学习化学常用的方法。下列归纳全部正确的是
A.操作顺序 | B.生活化学 |
①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
C.解释说明 | D.化学鉴别 |
①稀有气体作保护气,因为其化学性质稳定 | ①看颜色色鉴别羊毛纤维和棉纤维 |
A. A B. B C. C D. D
查看答案下列说法正确的是
A. 铜被广泛地运用于制造电线、电缆,因此铜是导电性最好的金属
B. 化学反应常常伴随着能量变化,因此有能量变化的都是化学反应
C. 盐酸、硫酸溶液中酸根离子不同,因此它们的化学性质存在差异
D. 某化肥加熟石灰研磨,没有嗅到氨味,因此该化肥一定不是氮肥
查看答案据报道,我国科学家发现一种氦钠化合物(化学式为Na2He)。下列说法正确的是( )
A. Na2He中Na为+1价,He为-1价 B. Na2He中Na、He元素的质量比为2:1
C. Na2He中含有金属元素和稀有气体元素 D. 稀有气体都很稳定,不与任何物质反应
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:单选题
除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
A 【解析】A、加水溶解,CaCl2能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,过滤,取滤液,加足量的稀盐酸,过量的碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,盐酸具有挥发性,再蒸发除去盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,正确;B、除去二氧化碳中的一氧化碳不能够通过量氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质氧气,错误;C、KCl能与适量的硝酸银...把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
查看答案下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
查看答案下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
查看答案归纳是学习化学常用的方法。下列归纳全部正确的是
A.操作顺序 | B.生活化学 |
①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
C.解释说明 | D.化学鉴别 |
①稀有气体作保护气,因为其化学性质稳定 | ①看颜色色鉴别羊毛纤维和棉纤维 |
A. A B. B C. C D. D
查看答案下列说法正确的是
A. 铜被广泛地运用于制造电线、电缆,因此铜是导电性最好的金属
B. 化学反应常常伴随着能量变化,因此有能量变化的都是化学反应
C. 盐酸、硫酸溶液中酸根离子不同,因此它们的化学性质存在差异
D. 某化肥加熟石灰研磨,没有嗅到氨味,因此该化肥一定不是氮肥
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:单选题
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
D 【解析】A、根据质量守恒定律可以知道:待测值=19+34+6+2-11-28-20=2,错误;B、根据题意反应生成了22g的二氧化碳和18g的水,消耗了32g 的氧气和8g的X,22g二氧化碳中含有氧元素的质量为22g× =16g; 18g水中含氧元素的质量为18g× =16g;生成物中氧元素的质量为16g+16g=32g,与参加反应的氧气的质量正好相等,说明X中一定只含有碳、氢两种元素...除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
查看答案把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
查看答案下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
查看答案下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
查看答案归纳是学习化学常用的方法。下列归纳全部正确的是
A.操作顺序 | B.生活化学 |
①制取O2停止加热时,先熄灭酒精灯,后撤导管 ②配制溶液需经过计算、称量、溶解等 | ①碳酸氢钠可用于治疗胃酸过多症 ②氢氧化钠可用来改良酸性土壤 |
C.解释说明 | D.化学鉴别 |
①稀有气体作保护气,因为其化学性质稳定 | ①看颜色色鉴别羊毛纤维和棉纤维 |
A. A B. B C. C D. D
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:填空题
(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。

①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入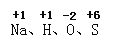 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
查看答案除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
查看答案把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
查看答案下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
查看答案下列各组离子在水中一定能大量共存的是
A. Na+、Fe3+、NO3-、H+ B. H+、K+、NO3-、CO32-
C. K+、Cu2+、OH-、SO42- D. OH-、NH4+、Cl-、SO42-
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:流程题
银铜合金广泛用于航空工业,切割废料中回收银并制备铜化工产品的工艺流程如图所示:【已知Al(OH)3和Cu(OH)2开始分解的温度分别为450℃ 和80℃ ,Al(OH)3和NaOH能发生反应NaAlO2和水。】

(1)写出铜银合金废料在空气中熔炼时的化学反应方程式___________________。
(2)操作Ⅰ的名称为____________。
(3)写出向CuSO4溶液中加入Al2(SO4)3和稀NaOH其中的一个化学反应方程式____________,其基本反应类型为__________________。
(4)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,原因是_________。
(5)煅烧固体B获得CuAlO2时通入惰性气体的作用______________,CuAlO2中铜元素的化合价为________价。
2Cu +O22CuO 过滤 Al2(SO4)3+6NaOH= 3Na2SO4+2 Al(OH)3↓或 CuSO4+2NaOH= Na2SO4+Cu(OH)2↓ 复分解反应 Al(OH)3和CuO 防止Al(OH)3和NaOH发生反应 作保护气 +1 【解析】本题是以从废料中回收银,并制备铜化工产品为背景,考查了混合物的分离、碱和盐的性质等知识。 (1) 在空气中进行熔炼时,铜能和空气...(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。

①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入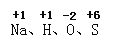 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
查看答案除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
查看答案把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
查看答案下列依据实验目的设计的实验方案中合理的是
A.除去铁制品表面的铁锈,用过量的稀硫酸长时间浸泡
B.验证甲烷中含有H2,点燃.在火焰上方罩一只干冷烧杯,观察内壁是否出现液滴
C.鉴别化肥KNO3和NH4CI,取样与熟石灰混合研磨,闻气味
D.检验NaOH是否变质,取样,加水溶解后滴加酚酞试液,观察溶液颜色是否变红
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:综合题
晓楠发现了许多有趣的化学问题,请你帮助她解释或解决这些问题.
(1)①天然降水中会溶解部分空气里的二氧化碳气体。因此正常雨水的pH___7(选填“>”或“=”或“<”)。
②发生火灾时,消防员利用高压水枪灭火的主要原理是________。
③电解水实验可以得出水的组成,该反应的化学方程式为___________。
(2)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______g;配制的主要步骤有:计算、________、混匀、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、____________(两种)和试剂瓶。
(3)①甲、乙两物质的溶解度曲线如下图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃________t℃(填“>”、“<”或“=”)。
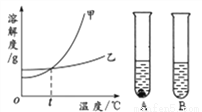
②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是_________(填字母序号)。
A.加10g水 B.加入少量甲物质 C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
(4)酒精是可再生能源,酒精完全燃烧的化学方程式为______________。
(5)将一定量铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,下列说法正确的是_______________。
A.滤出的固体中一定含有银和铜 B.向滤出的固体中加稀盐酸一定有气泡产生
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
< 降低温度至着火点以下 2H2O2H2↑+O2↑ 450 量取 量筒、玻璃棒 < C C2H5OH+3O22CO2+3H2O AD 【解析】本题主要考查了水的性质,溶液的配制,溶解度曲线的应用和金属活动性顺序的应用。 (1)①天然降水中会溶解部分空气里的二氧化碳气体,二氧化碳与水反应生成碳酸,碳酸呈酸性。因此正常雨水的pH<7; ②水在蒸发时吸热,可使可燃物的温度下降。发生火灾...银铜合金广泛用于航空工业,切割废料中回收银并制备铜化工产品的工艺流程如图所示:【已知Al(OH)3和Cu(OH)2开始分解的温度分别为450℃ 和80℃ ,Al(OH)3和NaOH能发生反应NaAlO2和水。】

(1)写出铜银合金废料在空气中熔炼时的化学反应方程式___________________。
(2)操作Ⅰ的名称为____________。
(3)写出向CuSO4溶液中加入Al2(SO4)3和稀NaOH其中的一个化学反应方程式____________,其基本反应类型为__________________。
(4)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,原因是_________。
(5)煅烧固体B获得CuAlO2时通入惰性气体的作用______________,CuAlO2中铜元素的化合价为________价。
查看答案(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。

①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入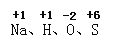 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
查看答案除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
查看答案把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z(NO3)2溶液中,M加入到YNO3溶液中。反应关系如图所示。据此判断四种金属的活动性顺序为

A. Z>X>M>Y B. X>Z>M>Y C. X>Z>Y>M D. Y>M>Z>X
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:综合题
某小组同学以纯碱和熟石灰为原料制烧碱,其化学方程式为________________。
该小组同学将反应后混合物过滤,将滤液蒸发,即得到烧碱固体。
【问题与发现】该小组同学所得到固体一定是纯净的NaOH吗?
【猜想与假设】小明:纯净的NaOH 小军:NaOH和Na2CO3的混合物 小华:__________________
【探究与验证】三位同学分别设计下列方案,对自己的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
小明 | 取少量样品,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
小军 | 取少量样品,溶于适量水形成溶液后,滴加足量_________ | 有气泡产生 | 猜想成立 |
小华 | 取少量样品,溶于适量水形成溶液后,滴加碳酸钠溶液 | __________ | 猜想不成立 |
【反思与评价】请你根据实验流程对小明同学设计的方案进行合理的评价:__________。
【拓展探究】小军同学定量分析所制取氢氧化钠固体样品中氢氧化钠的含量。
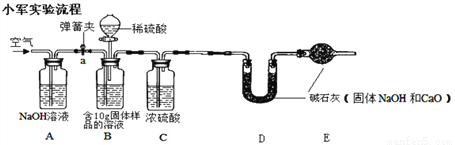
实验步骤如下①检查好装置气密性,装好药品后连接并固定好装置;
②打开弹簧夹a,通入一段时间的空气,精确称量D装置质量记录为100g;
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生;
④打开弹簧夹a, 继续通入一段时间空气,再精确称量D装置质量记录为101.1g ……
实验分析:(1)实验中C装置作用是______________。
(2)实验步骤④中,继续通入一段时间空气的目的是__________________。
(3)样品中氢氧化钠的含量为________。(计算结果精确到小数点后一位);如果没有装置E,则测定结果与实际结果相比会_____(填“偏大”、“偏小”或“无影响”)。
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ NaOH和Ca(OH)2 稀盐酸或稀硫酸 无明显现象 小明同学设计的方案不合理,纯碱溶液和氢氧化钙反应生成氢氧化钠,但二者不一定恰好反应;纯碱溶液和氢氧化钙溶液均显碱性,无论哪种物质过量,均能使酚酞试液变红 干燥二氧化碳 使生成的二氧化碳完全被吸收 73.5% 偏小 【解析】本题考查了探究反应后溶液成分并定量分析所制取氢氧化...晓楠发现了许多有趣的化学问题,请你帮助她解释或解决这些问题.
(1)①天然降水中会溶解部分空气里的二氧化碳气体。因此正常雨水的pH___7(选填“>”或“=”或“<”)。
②发生火灾时,消防员利用高压水枪灭火的主要原理是________。
③电解水实验可以得出水的组成,该反应的化学方程式为___________。
(2)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______g;配制的主要步骤有:计算、________、混匀、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、____________(两种)和试剂瓶。
(3)①甲、乙两物质的溶解度曲线如下图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃________t℃(填“>”、“<”或“=”)。

②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是_________(填字母序号)。
A.加10g水 B.加入少量甲物质 C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
(4)酒精是可再生能源,酒精完全燃烧的化学方程式为______________。
(5)将一定量铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,下列说法正确的是_______________。
A.滤出的固体中一定含有银和铜 B.向滤出的固体中加稀盐酸一定有气泡产生
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
查看答案银铜合金广泛用于航空工业,切割废料中回收银并制备铜化工产品的工艺流程如图所示:【已知Al(OH)3和Cu(OH)2开始分解的温度分别为450℃ 和80℃ ,Al(OH)3和NaOH能发生反应NaAlO2和水。】

(1)写出铜银合金废料在空气中熔炼时的化学反应方程式___________________。
(2)操作Ⅰ的名称为____________。
(3)写出向CuSO4溶液中加入Al2(SO4)3和稀NaOH其中的一个化学反应方程式____________,其基本反应类型为__________________。
(4)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,原因是_________。
(5)煅烧固体B获得CuAlO2时通入惰性气体的作用______________,CuAlO2中铜元素的化合价为________价。
查看答案(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。

①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入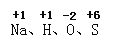 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
查看答案除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A. NaCl(CaCl2)——溶解,加入过量的碳酸钠溶液,过滤,取滤液,加足量的稀盐酸,蒸发
B. CO2 (CO)——通入过量的氧气后点燃
C. NaNO3溶液(KCl)——加入适量的硝酸银溶液,过滤
D. CuO (Cu) ——加过量的稀盐酸,过滤,洗涤,干燥
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
科目: 来源:江苏省等八校2018届九年级下学期第一次阶段测试化学试卷 题型:综合题
我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)铁合金属于________。A.合成材料 B.复合材料 C.金属材料 D.天然材料
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):下图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
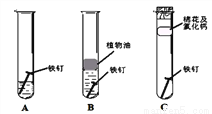
II.赤铁矿(主要成分为Fe2O3)可用于炼铁。
(3)在Fe2O3中,铁、氧元素的质量比为____________。
(4)某钢铁厂每天消耗2000t含Fe2O376%的赤铁矿石,该厂理论上可日产含Fe98%的生铁的质量是________________?(需要写出计算过程计算,结果保留一位小数)
C 化学 A 7:3 1085.7t 【解析】本题考查了金属材料,铁的锈蚀的条件和根据化学反应方程式的计算。 (1)铁合金属于金属材料,故选C; (2)铁钉生锈,铁锈是主要成分为氧化铁的物质,不同于铁,该变化为化学变化。铁在同时接触空气和水的情况下生锈最快,故选A。 (3)在Fe2O3中,氧元素的质量比=56×2:16×3=7:3; (4)设:该厂理论上可日产含Fe9...某小组同学以纯碱和熟石灰为原料制烧碱,其化学方程式为________________。
该小组同学将反应后混合物过滤,将滤液蒸发,即得到烧碱固体。
【问题与发现】该小组同学所得到固体一定是纯净的NaOH吗?
【猜想与假设】小明:纯净的NaOH 小军:NaOH和Na2CO3的混合物 小华:__________________
【探究与验证】三位同学分别设计下列方案,对自己的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
小明 | 取少量样品,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
小军 | 取少量样品,溶于适量水形成溶液后,滴加足量_________ | 有气泡产生 | 猜想成立 |
小华 | 取少量样品,溶于适量水形成溶液后,滴加碳酸钠溶液 | __________ | 猜想不成立 |
【反思与评价】请你根据实验流程对小明同学设计的方案进行合理的评价:__________。
【拓展探究】小军同学定量分析所制取氢氧化钠固体样品中氢氧化钠的含量。

实验步骤如下①检查好装置气密性,装好药品后连接并固定好装置;
②打开弹簧夹a,通入一段时间的空气,精确称量D装置质量记录为100g;
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生;
④打开弹簧夹a, 继续通入一段时间空气,再精确称量D装置质量记录为101.1g ……
实验分析:(1)实验中C装置作用是______________。
(2)实验步骤④中,继续通入一段时间空气的目的是__________________。
(3)样品中氢氧化钠的含量为________。(计算结果精确到小数点后一位);如果没有装置E,则测定结果与实际结果相比会_____(填“偏大”、“偏小”或“无影响”)。
查看答案晓楠发现了许多有趣的化学问题,请你帮助她解释或解决这些问题.
(1)①天然降水中会溶解部分空气里的二氧化碳气体。因此正常雨水的pH___7(选填“>”或“=”或“<”)。
②发生火灾时,消防员利用高压水枪灭火的主要原理是________。
③电解水实验可以得出水的组成,该反应的化学方程式为___________。
(2)现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为______g;配制的主要步骤有:计算、________、混匀、装瓶并贴上标签;实验中用到的玻璃仪器有胶头滴管、烧杯、____________(两种)和试剂瓶。
(3)①甲、乙两物质的溶解度曲线如下图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃________t℃(填“>”、“<”或“=”)。

②20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是_________(填字母序号)。
A.加10g水 B.加入少量甲物质 C.升温到40℃ D.蒸发部分溶剂,恢复到20℃
(4)酒精是可再生能源,酒精完全燃烧的化学方程式为______________。
(5)将一定量铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,下列说法正确的是_______________。
A.滤出的固体中一定含有银和铜 B.向滤出的固体中加稀盐酸一定有气泡产生
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
查看答案银铜合金广泛用于航空工业,切割废料中回收银并制备铜化工产品的工艺流程如图所示:【已知Al(OH)3和Cu(OH)2开始分解的温度分别为450℃ 和80℃ ,Al(OH)3和NaOH能发生反应NaAlO2和水。】

(1)写出铜银合金废料在空气中熔炼时的化学反应方程式___________________。
(2)操作Ⅰ的名称为____________。
(3)写出向CuSO4溶液中加入Al2(SO4)3和稀NaOH其中的一个化学反应方程式____________,其基本反应类型为__________________。
(4)固体混合物B的组成为______;在生成固体B的过程中,必须控制NaOH的加入量,原因是_________。
(5)煅烧固体B获得CuAlO2时通入惰性气体的作用______________,CuAlO2中铜元素的化合价为________价。
查看答案(1)二氧化硅可用于制造分离膜,利用“膜分离”技术可使二氧化碳穿过分离膜被氨水吸收(如右下图)生成可用作化肥的碳酸氢铵(NH4HCO3)。

①碳酸氢铵属于______(填“氮肥”、“磷肥”、“钾肥”或“复合肥”)。
②二氧化硅的化学式为________。
③氨水中含有一定浓度的氢氧根离子,氢氧根离子的符号是_________。
(2)请从入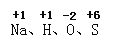 中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
中选择合适的元素,按物质的分类写出相应物质的化学式(各写一例)。①氧化物:_______;②酸:________;③盐:________。
在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
查看答案 试题属性 Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
Copyright @ 2008-2013 满分5 学习网 ManFen5.COM. All Rights Reserved.答案无忧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com