
科目: 来源:北京市毕业考试化学试卷 题型:科学探究题
19世纪末,科学家瑞利通过如下两种方法制得氮气,并测得其密度,从而获得科学史上的重大发现。请你参与以下的科学发现过程。
方法Ⅰ:利用空气分离出氮气
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过氢氧化钠溶液,再通过浓硫酸。 | 通过浓硫酸的目的是为了除去空气中的_______________。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体)。 | 请写出一种能用于除去氧气的物质__________。 |
(3)收集剩余气体,并测定该气体的密度。 | 密度:1.257 2 g/L |
方法Ⅱ:用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质。测得氮气的密度为1.250 8 g/L。该反应的化学方程式为____________。
讨论:瑞利教授经过多次实验,发现方法Ⅱ测得的结果均小于方法Ⅰ,试分析其原因__________。
水蒸气 红磷等 NaNO2 + NH4Cl === N2↑+ NaCl + 2H2O 方法Ⅰ得到的气体中除氮气外,还有稀有气体。 【解析】本题考查了浓硫酸的性质,氧气的性质,化学方程式的书写,空气的成分。 (1)浓硫酸具有吸水性,能除去空气中的水蒸气; (2)红磷能与氧气反应生成五氧化二磷固体。能用于除去氧气的物质可以是红磷; (3)亚硝酸钠(NaNO2)和氯化铵(NH4C...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:简答题
阅读下面科普短文。
漫谈水果的保鲜
“日啖荔枝三百颗,不辞长做岭南人”,表达了诗人赞美荔枝甘美、喜爱荔枝之情。水果不仅带给我们味觉上的美好享受,更能提供丰富的营养。但是有时水果的保存也会给我们带来小小的烦恼,保存不当,水果会失水或腐烂变质。
在水果的冰点温度下储藏,能较长时间保持鲜果固有的品质和营养,这项技术叫冰温储藏。为了探究荔枝的冰温储藏(荔枝的冰点温度为-1.2℃)是否优于普通冷藏(温度通常为0~10℃)。科研人员设计了一组实验,实验条件如表1所示。以荔枝的还原糖含量作为衡量荔枝品质变化的指标(还原糖含量越高,品质越好),每隔七天进行一次水果品质检测,实验结果见图1。
表1 实验条件
组号 | 储藏温度 | 湿度 | 备注 |
1 | -1.2℃ | 87% | 荔枝的品种、大小、成熟度、数量以及其他条件均相同且适宜 |
2 | 3℃ | 87% |
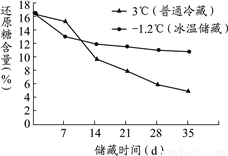
图1 还原糖含量变化
氧气的浓度也影响着水果的保鲜。在储存水果时为了抑制呼吸作用,一般要降低氧气的浓度,当二氧化碳释放量最小时,呼吸作用最弱,此时对应的氧气浓度适宜水果的储存。如果降得太低,植物组织就进行无氧呼吸,无氧呼吸的产物往往对细胞有一定的毒害作用,影响蔬菜水果的保鲜。
此外,储存时还要注意有些水果不能和其他蔬果一起存放,如苹果、木瓜、香蕉等。这类水果在成熟过程中会释放“乙烯”气体,可加速水果的成熟和老化。坏掉的水果也会释放乙烯,因此在一堆水果中,如果有一颗是坏的,要尽快挑出去。
依据文章内容,回答下列问题:
(1)乙烯___________(填“能”或“不能”)催熟水果。
(2)在文中的荔枝实验中,研究的影响水果储藏的因素是 ________。
(3)通过图1可得到的信息是________(写出1条即可)。
(4)下列说法不正确的是________。
A.荔枝的还原糖含量在冰温储藏时始终高于普通储藏
B.氧气浓度越低越有利于水果的保鲜
C.普通冷藏温度指的是3℃
(5)请举出日常生活中水果保鲜的方法_________(写出一种即可)。
能 储藏温度 超过一定天数后,荔枝冰温储藏比普通冷藏保鲜效果要好 ABC 装入保鲜袋(其他合理答案均可) 【解析】(1)根据水果在成熟过程中会释放“乙烯”气体,可加速水果的成熟和老化解答。 (2)根据表1信息分析解答; (3)根据图1中还原糖的含量和储藏时间分析解答; (4)根据文中信息解答; (5)根据日常生活经验解答。 【解析】 (1)水果在成熟过程中会释...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:简答题
烟道气中含有大量CO2,经“捕捉”可用于生产甲醇等产品。
(1) “捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是________。
(2)用“捕捉”的CO2生产甲醇,反应的微观示意图如下:

该反应的化学方程式为__________________________________。
CO2 CO2 + 3H2 CH3OH + H2O 【解析】本题考查了溶质与溶剂的判定和微粒模型的应用。 (1) 气体溶于液体中,液体是溶剂,气体是溶质。CO2的甲醇溶液中溶质是CO2; (2)由微观粒子的反应过程可知,二氧化碳和氢气在一定条件下反应生成甲醇和水,反应的化学方程式为CO2 + 3H2 CH3OH + H2O;查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:填空题
矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准。
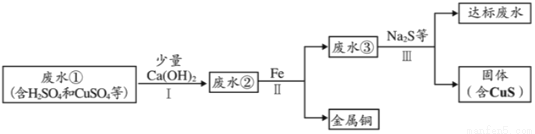
已知:步骤I无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是___________________;
(2)步骤Ⅱ得到金属铜的反应的化学方程式为___________________________;
(3)加入Ca(OH)2可以降低铁屑的消耗量,原因是_______________________;
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有__________________。
过滤 Fe + CuSO4 ==== Cu + FeSO4 Ca(OH)2会与废水中的硫酸发生反应,消耗了废水中的硫酸,减少了铁屑与硫酸的反应 CuSO4(或Cu2+) 【解析】本题主要考查酸碱盐的化学性质,金属的化学性质。硫酸与氢氧化钙反应生成硫酸钙和水,硫酸铜与氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,铁和硫酸铜反应生成硫酸亚铁和铜, (1)能过步骤Ⅱ和步骤Ⅲ都是变成液体和固体,所以是...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:推断题
A、B、C、D 是初中化学常见物质,下图是包含A、B、C、D和盐酸5种物质的“化学拼图”,相邻两张卡片所标的物质间能发生反应。
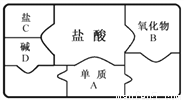
(1)单质A不可能是______。
A.Mg B.Fe C.Ag D.Zn
(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为__________________。
(3)若C为碳酸钠。
①C与D反应的化学方程式为________________________。
②将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有______种。
C Fe2O3+6HCl=== 2FeCl3+3H2O Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 3 【解析】本题主要考查了酸的化学性质和化学方程式的书写。 (1)由金属活动性顺序可知,排在氢前面的金属可以将酸中的氢置换出来,所以铁、镁、锌能和盐酸反应,银不会与盐酸反应,故选C; (2)氧化铁和盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=== 2...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:实验题
根据下列实验装置图,回答问题。
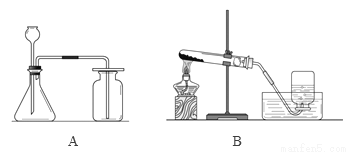
(1)实验室制取二氧化碳的化学方程式为____________,应选用的装置是______(填序号),选择该装置的原因是___________________。
(2)实验室用加热高锰酸钾制取氧气的化学方程式为_____________________________。
CaCO3 + 2HCl === CaCl2 + CO2↑+ H2O A 反应为固体和液体之间在不加热的条件下发生,且收集的气体密度大于空气能溶于水 2KMnO4 K2MnO4 + MnO2 + O2↑ 【解析】本题考查实验装置的选择和化学方程式的书写。选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:简答题
以下两组实验都采用了对比的方法。

(1)实验Ⅰ,将二氧化碳倒入烧杯中,观察到的现象是___________________,说明二氧化碳具有的性质是______________________________________________。
(2)实验Ⅱ,通过甲、乙对比可得出的结论是____________________________________。
蜡烛自下而上依次熄灭 二氧化碳不燃烧、不支持燃烧、密度大于空气 浓氨水中氨分子不断运动,并可使酚酞溶液变红 【解析】本题考查了二氧化碳原性质和微粒运动的探究。 (1)实验Ⅰ,将二氧化碳倒入烧杯中,观察到的现象是蜡烛自下而上依次熄灭,说明二氧化碳具有的性质是二氧化碳不燃烧、不支持燃烧、密度大于空气; (2)实验Ⅱ,通过甲、乙对比可得出的结论是浓氨水中氨分子不断运动,并可使酚酞溶液变...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:科学探究题
化学兴趣小组用下图所示装置研究两个问题(夹持装置已略去)。
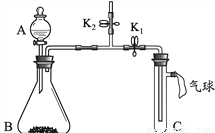
(1)研究燃烧的条件
【步骤1】向C中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧。
【步骤2】打开K1,关闭K2,将A中溶液滴入B中,C中有气泡冒出,白磷燃烧。B中发生反应的化学方程式为__________________。此实验运用对比的方法研究了燃烧的一个条件,它是_______________________。
(2)研究二氧化碳与氢氧化钠的反应
A中盛有稀硫酸,B中盛有碳酸钠固体,C中盛有氢氧化钠固体。
【实验1】打开K1,关闭K2,将A中溶液滴入B中,气球明显鼓起。打开K2,关闭K1,一段时间后,气球没有明显变瘪。
实验1没有出现预期的实验现象,改进后重新加入药品进行了实验2。
【实验2】打开K2,关闭K1,将A中溶液滴入B中,用燃着的木条放在K2上方的导管口处,木条熄灭。上述实验操作的目的是____________________。然后进行后续实验,证明二氧化碳与氢氧化钠发生了反应,后续实验的操作及现象是_____________________。
2H2O2 2H2O + O2↑ 燃烧需要氧气 排出B中的空气 打开K1,关闭K2,气球明显鼓起。打开K2,关闭K1,一段时间后,气球明显变瘪 【解析】本题考查了燃烧的条件和化学反应方程式的书写、以及二氧化碳的性质。(1)根据物质燃烧的条件进行分析;(2)根据二氧化碳不支持燃烧的特点分析操作目的;证明产生的气体二氧化碳减少,说明二氧化碳与氢氧化钠反应。 (1)B中应是过氧化氢溶液和二氧...查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:科学探究题
化学小组受英国科学家法拉第《蜡烛的化学史》的启发,对蜡烛的燃烧过程进行了再一次探究。

【查阅资料】
硫酸铜(CuSO4)是一种白色粉末,易吸水,吸水后变为蓝色。
【进行实验】
序号 | 实验步骤 | 实验现象 | 实验结论 |
I |
| 外焰处的铁纱网出现红热的环,内焰及焰心处的铁纱网无明显变化 | |
II |
| 伸入焰心的导气管引出白烟, | 焰心处有可燃性气体 |
III |
| 蜡烛燃烧的产物中有水和二氧化碳 |
(1)实验I得到的结论是_________________________________________________。
(2)补全实验II的实验现象______________________________________________。
(3)实验III中,硫酸铜粉末的作用是___________________;得到“蜡烛燃烧的产物中含有二氧化碳”这一结论所对应的实验现象是___________________________。
(4)依据实验III,可以得到关于蜡烛的元素组成情况是________________________。
【反思与评价】
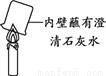
(5)实验III是该小组同学对右图所示实验的改进。与右图所示实验相比,实验3的优点是______。
查看答案和解析>>
科目: 来源:北京市毕业考试化学试卷 题型:计算题
1000 mL某饮用矿泉水的成分如图所示。

(1)此矿泉水中至少含有________种元素。
(2)在H2SiO3中,氢、氧原子的个数比为___________。
(3)在H2SiO3中,硅元素质量分数的计算式为_____________。
(4)某同学喝了500 mL该矿泉水,他摄入钾元素的质量为________mg。
7 2:3 ×100% 2.5 【解析】(1)由饮用矿泉水中的成分表可知,此矿泉水中至少含有氢、硅、氧、钾、钠、钙、镁7种元素; (2)根据H2SiO3的化学式可知:在H2SiO3中,氢、氧原子的个数比= 2:3; (3)硅元素的质量分数的计算式为×100%; (4)某1000g饮用矿泉水中含有钾5mg,则某同学喝了500g该矿泉水,他同时摄入的钾元素的质量为5mg×=2....查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com