
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:单选题
实验室制取二氧化碳时,为了控制反应的发生与停止,可选用的装置(铁架台省略)是
A. 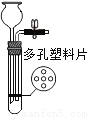 B.
B. 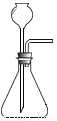 C.
C. 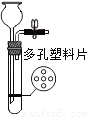 D.
D. 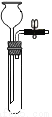
查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:单选题
有关化学反应的说法错误的是
A. 化合反应一定生成氧化物 B. 中和反应一定是生成盐和水的反应
C. 置换反应中一定有单质生成 D. 分解反应一定只有一种反应物
A 【解析】A、化合反应的生成物不一定是氧化物,例如氧化钙和水反应生成氢氧化钙,氢氧化钙属于碱,错误;B、中和反应是酸和碱生成盐和水的反应,正确;C、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,所以置换反应中一定有单质生成,正确;D、分解反应是一种物质生成多种物质的化学反应,正确。故选A。查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:单选题
在上海家用燃料使用的发展历程中(括号内表示主要成分)。有关说法错误的是
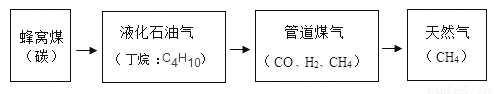
A. 燃料燃烧时均放出热量
B. 煤、石油、天然气都属于化石燃料
C. 管道煤气有毒,天然气无毒
D. 1mol甲烷比1mol丁烷完全燃烧后CO2排放量高
D 【解析】A、燃料燃烧属于氧化反应,氧化反应均放出热量,正确; B、化石燃料包含煤、石油、天然气,正确; C、管道煤气中含有一氧化碳,一氧化碳有毒,天然气主要成分是甲烷,甲烷无毒,正确;D、甲烷的分子式为CH4,丁烷的分子式为C4H10,甲烷的含碳量小,所以1mol甲烷比1mol丁烷完全燃烧后CO2排放量低,错误。故选D。查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:单选题
不用鉴别稀盐酸、氢氧化钠溶液、氯化钠溶液的是
A. 无色酚酞试液 B. 紫色石蕊试液 C. 氯化钙溶液 D. 氯化铜溶液
C 【解析】A、无色酚酞溶遇酸性溶液不变色,遇碱性溶液变红色,稀盐酸、氯化钠溶液和氢氧化钠溶液分别显酸性、中性、碱性,使酚酞溶液分别显示无色、无色、红色,可以鉴别出氢氧化钠溶液,再将显红色的氢氧化钠溶液加入上述两种无色溶液中,红色消失的为稀盐酸,不变的为氯化钠溶液,故能鉴别,正确;B、紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,稀盐酸、氯化钠溶液和氢氧化钠溶液分别显酸性、中性、碱性,使石蕊溶...查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:单选题
向含有少量硝酸银的废液中加入一定量的铁屑,充分反应后过滤,有关滤渣和滤液成分 判断,不可能出现的组合是
成分 选项 | A | B | C | D |
滤渣 | Ag | Ag,Fe | Ag | Ag,Fe |
滤液 | Fe(NO3)2 | Fe(NO3)2 | AgNO3,Fe(NO3)2 | AgNO3,Fe(NO3)2 |
A. A B. B C. C D. D
D 【解析】根据在金属活动性顺序中,铁排在银的前边,可以和硝酸银溶液反应生成银和硝酸亚铁,当铁加入量较少时,与部分硝酸银反应,生成物中滤渣为Ag,滤液为AgNO3、Fe(NO3)2;当铁恰好与硝酸银反应,生成物中滤渣为Ag,滤液为Fe(NO3)2;当铁过量时,生成物中滤渣为Ag、Fe,滤液为Fe(NO3)2。故选D。查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:综合题
空气、水、食盐是人类赖以生存的自然资源,请回答下列问题:
①海水中能提取食盐,则食盐中金属元素的名称是_________。食盐可以配成0.9%的生理盐水,“0.9%”表示_________。(选填编号)
A.每100g水中最多溶解 0.9g NaCl B.每100g生理盐水中溶解0.9g NaCl
C.生理盐水中有0.9g NaCl D.生理盐水中溶质的质量分数
②工业上分离液态空气制氧气,是利用氧气和氢气_________不同(选填“溶解性”“沸点”或“熔点”)
③废气处理有利于治理环境,工业烟气中排放的SO2经过下列转化可以得到化工产品。
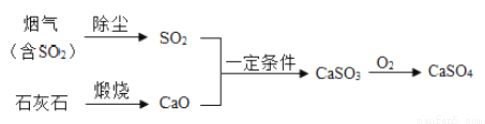
Ⅰ. 加入石灰石的目的是将SO2最终转化为______物质,写出煅烧石灰石的化学方程式_______。
Ⅱ. 在处理过程中,元素化合价发生改变的元素有___________。
④天然水中含有许多杂质。自来水厂净水过程示意图为:天然水 沉降过滤
沉降过滤  自来水。加氯的作用是___________。明矾的化学式是 KAl(SO4)2 ·12H2O,该物质中含有__________种元素,0.2 mol中KAl(SO4)2 ·12H2O 含有__________个钾微粒。
自来水。加氯的作用是___________。明矾的化学式是 KAl(SO4)2 ·12H2O,该物质中含有__________种元素,0.2 mol中KAl(SO4)2 ·12H2O 含有__________个钾微粒。
查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:填空题
如图是甲、乙两种固体(不含结晶水)物质的溶解度曲线。
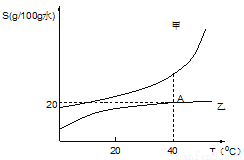
①写出A点表示的意义是________________________
②盐碱湖中溶有大量的“NaCl和Na2CO3”,当地的人们”冬天捞碱,夏天捞盐”,据 此判断图中__________(选填“甲”或“乙”)物质的溶解度与纯碱类似。
③在40℃时,将12 g乙物质加入50 g水中充分搅拌。有__________g固体未溶解, 如要使其溶解,可采用的方法是____________________。
④40℃时,甲、乙物质饱和溶液降温至20℃时,对此过程判断一定正确的是__________。
Ⅰ. 现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量
Ⅱ. 溶解度:溶解度都变小:S甲>S乙
Ⅲ. 溶液状态:都为饱和溶液,甲溶质的质量分数>乙溶质的质量分数
Ⅳ. 溶剂变化:溶剂的质量不变,乙溶液中溶剂质量>甲溶液中溶剂质量
40°时,乙的溶解度为20g/100g水 甲 乙 升高温度或加入一定量水 II、III 【解析】①由图线可知,A点表示40°时,乙的溶解度为20g/100g水; ②“冬天捞碱”,说明纯碱的溶解度随温度的升高而增大,所以图中甲物质的溶解度与类似。 ③40℃时乙的溶解度是20g/100g水,12g乙物质加到50g水中,充分搅拌后,还有2g固体未溶解,如果要使其溶解,可以升高温度,因为...查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:流程题
某黄铜渣中约含质量分数为7% Zn、50%Cu、5%CuO,其余为杂质(杂质不溶于水, 也不参与反应),处理黄铜渣可得到硫酸锌,其主要流程如下:
(已知 ZnO + H2SO4 → ZnSO4 + H2O)
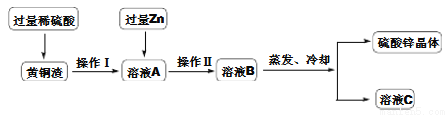
①Ⅰ、Ⅱ中的实验操作均为____________。
②溶液A中ZnSO4的质量________CuSO4(选填“>”“<”或“=”)
③写出过量锌加入溶液A中发生反应的化学方程式________________________。
过滤 > Zn+CuSO4=Cu+ZnSO4 【解析】①Ⅰ、Ⅱ中的实验操作均把固体和液体分开,所以为过滤; ②氧化锌的质量大于氧化铜,另外锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜; ③溶液A中含有硫酸锌和硫酸铜,锌与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Zn+CuSO4=Cu+ZnSO4。查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:综合题
某含铁和炭的黑色粉末,为测定其中铁粉的质量分数,进行以下实验:称量10.0g样品放入50.0g的锥形瓶中,再加入过量稀硫酸100g(如图一)立即开始记录读数(如图二),回答下列问题:
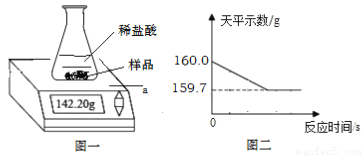
①图一中a的仪器名称是_________。10.0g样品转移到锥形瓶中需要使用的仪器是 _________。
②写出锥形瓶中发生反应的化学方程式____________。反应生成氢气的物质的量是_________mol。
③样品中铁粉的质量分数是_________。(根据化学方程式进行列式计算)
④根据锥形瓶中的反应绘制的图像正确的是_________。
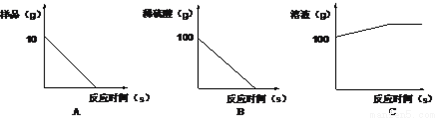
查看答案和解析>>
科目: 来源:上海市黄浦区2018届九年级4月模拟考试化学试卷 题型:简答题
当稀盐酸与稀氢氧化钠溶液混合后仍为无色溶液,为证明反应确实发生,进行以下实验。
实验一:向装有一定量稀氢氧化钠溶液的试管中滴加几滴酚酞溶液,再滴加稀盐酸,并不断振荡溶液。若观察到____________现象,则证明反应发生,写出反应的化学方程式_______________。
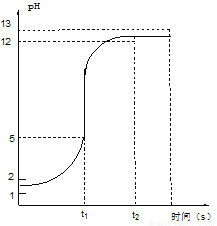
实验二:取一定量的稀盐酸,逐滴匀速滴加稀氢氧化钠溶液,测得反应过程中pH变化 (20℃)如图所示:
①从0→t2时,溶液的酸碱性变化情况是______________________。
②根据曲线的变化,判断反应恰好完成的依据是_________________________。
③t2时,所得溶液中的溶质是__________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com