
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:单选题
为得到纯净的物质,某同学设计下表中的除杂方法,其中方法正确的是 ( )
物质 | 所含杂质 | 除去杂质的方法 | |
A | NaCl溶液 | Na2C03 | 加人稀硫酸至不再产生气泡 |
B | Cu0粉末 | C | 加入过量稀盐酸,充分反应 |
C | N2气体 | 02 | 将气体缓缓通过灼热的铜网 |
D | KCl溶液 | CuCl2 | 加入氢氧化钠溶液至不再产生沉淀 |
A. A B. B C. C D. D
C 【解析】A、Na2CO3与Na0H均能与盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误. B、CuO能与稀盐酸反应生成硫铜和水,铜不与稀盐酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. C、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,氮气不与铜反应,将气体缓缓通过灼热的铜网,反而会把原物质除去,不符合除杂原...查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:单选题
m克20%的氢氧化钠溶液与n克20%的盐酸恰好完全,如果将m克20%的氢氧化钠溶液改为m克20%的氢氧化钾溶液,充分反应后所得溶液的pH ( )
A. pH<7 B. pH=7 C. pH>7 D. 无法判断
A 【解析】设盐酸的质量为36.5,则 HCl+NaOH═NaCl+H2O 36.540 HCl+KOH═KCl+H2O 36.556 观察化学方程式可以看出,消耗相同的盐酸需要氢氧化钾的量多,当使用相同量的氢氧化钠、氢氧化钾来与盐酸反应时,盐酸有剩余,故溶液呈酸性, pH<7 ;故选A。查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:单选题
某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是 ( )

A. HCl和H2SO4一定存在
B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和MgCl2一定存在
D. HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
C 【解析】由图中可知,加入氢氧化钡溶液时,开始不产生沉淀,说明溶液中不含有硫酸,含有盐酸;溶液中含有盐酸时,一定不含有氢氧化钠,因为盐酸和氢氧化钠不能共存;当盐酸和氢氧化钡完全反应后,再加入氢氧化钡溶液时,产生沉淀,是因为氢氧化钡和氯化镁反应生成了氢氧化镁沉淀,因此溶液中含有氯化镁;由分析可知,溶液中含有盐酸和氯化镁,不含有硫酸和氢氧化钠;故选:C。查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:填空题
.A、B、C三种固体物质的溶解度曲线如图所示。据图完成下列问题:

(1)20 ℃时,取100 g A物质的饱和溶液,将温度升高到35 ℃,此时溶液中溶质的质量分数是____________(填“变大”“变小”或“不变”)。
(2)要将A从它的饱和溶液中结晶出来,最好采取_______________的方法。
(3)而要将B从它的饱和溶液中大量析出,最好采取____________的方法。
不变 降温结晶 蒸发结晶 【解析】 (1)20℃时,取100gA物质的饱和溶液,将温度升高到35℃时,因A的溶解度随温度的升高而升高,所以溶液会由饱和溶液变为不饱和溶液,但溶液中溶质的质量分数保持不变;(2)因A的溶解度受温度影响较大,所以要将A从它的饱和溶液中结晶出来,最好采取降温结晶的方法;(3)B的溶解度受温度影响较小的,所以要将B从它的饱和溶液中大量析出,最好采取蒸发溶剂法。查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:推断题
如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“﹣”表示相连两物质之间能相互反应.

(1)按物质分类,C属于_____(填“氧化物”、“酸”、“碱”或“盐”)。
(2)写出C的一种物质与NaOH反应的化学方程式:______。
(3)NaOH与A反应的实验现象是_____________________。
酸 HCl+ Na OH = NaCl+H2O(合理即可,如稀硫酸或稀硝酸与氢氧化钠反应) 2Na OH+ CuSO4 =Cu(OH)2↓+ Na2SO4 【解析】(1)由碱的化学性质:碱能与非金属氧化物、酸、盐等反应;A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,则A为硫酸铜溶液;B能用于灭火,则B为二氧化碳,为非金属氧化物;故C属于酸,酸与碱发生中和反应;(2)C...查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:简答题
将生锈的铁钉放入过量的稀盐酸中,稍加热,开始观察到的现象是红色铁锈逐渐溶解,溶液变为黄色,发生反应的化学议程式为__________________________;反应一段时间后,可观察到铁钉表面有___________产生。发生反应的化学议程式为__________________________________。
Fe2O3+6HCl=2FeCl3+3H2O 气泡 Fe+2HCl=FeCl2+H2↑ 【解析】铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,溶液由无色变成黄色,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;当铁锈完全反应后,铁与盐酸发生反应,生成氯化亚铁与氢气,会观察到有气...查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:计算题
将50g石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量为141.2g
(1)石灰石中碳酸钙的质量分数是多少?
(2)所用盐酸的溶质质量分数是多少?
(3)反应后,过滤所得溶液的溶质质量分数是多少?
略 【解析】根据质量守恒定律计算生成的二氧化碳的质量;根据化学方程式和题中所给的数据计算参加反应的氯化氢、碳酸钙的质量、生成氯化钙的质量,然后计算质量分数。 【解析】 生成二氧化碳的质量为:50g+100g-141.2g=8.8g; 设参加反应碳酸钙的质量为x,参加反应氯化氢的质量为y,生成氯化钙的质量为z。 CaCO3+2HCl═CaCl2+H2O+CO2 100...查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:科学探究题
将50g石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量为141.2g
(1)石灰石中碳酸钙的质量分数是多少?
(2)所用盐酸的溶质质量分数是多少?
(3)反应后,过滤所得溶液的溶质质量分数是多少?
【答案】略
【解析】根据质量守恒定律计算生成的二氧化碳的质量;根据化学方程式和题中所给的数据计算参加反应的氯化氢、碳酸钙的质量、生成氯化钙的质量,然后计算质量分数。
【解析】
生成二氧化碳的质量为:50g+100g-141.2g=8.8g;
设参加反应碳酸钙的质量为x,参加反应氯化氢的质量为y,生成氯化钙的质量为z。
CaCO3+2HCl═CaCl2+H2O+CO2
100 73 111 44
x y z 8.8g
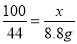 ,
, 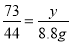 ,
, 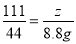
x=20g,y=14.6g,z=22.2g
石灰石中碳酸钙的质量分数=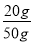 ×100%=40%;
×100%=40%;
所以所用盐酸的溶质质量分数=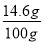 ×100%=14.6%;
×100%=14.6%;
所得溶液的溶质质量分数=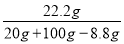
 100%=20%;
100%=20%;
答案:(1)石灰石中碳酸钙的质量分数是40%;(2)所用盐酸的溶质质量分数是14.6%;(3)反应后,过滤所得溶液的溶质质量分数是20%。
【题型】计算题
【结束】
17
某化学兴趣小组按以下方案探究室温时硫酸铵饱和溶液的酸碱度。
【猜想与假设】溶液的pH可能为:①_________,②_________,③________。
【设计与实验】要测定该溶液的酸碱度,不能采用下列物质中的_______(填序号)来进行实验。
①紫色石蕊试液 ②无色酚酞 ③pH试纸
组内同学分别进行如下实验:
甲同学:取pH试纸放在玻璃片上,用干净玻璃棒蘸取硫酸铵溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡对照,测得pH<7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用干净玻璃棒蘸取沾在pH试纸上,把试纸显示的颜色与标准比色卡对照,测得pH<7。
丙同学:将pH试纸直接浸入硫酸铵溶液中,把试纸显示的颜色与标准比色卡对照,测得pH<7。
【评价与反思】三位同学中,操作正确的是____同学,指出其余两位同学操作上的错误:①_____________________________,②_______________________________。造成的后果分别为:①________________________,②__________________________。
【结论与分析】该小组同学根据实验得出以下结论: ①硫酸铵溶液虽然显酸性,但硫酸铵不是酸,而是盐。②凡是盐的溶液都显酸性。
你认为上述结论错误的是第______条(填①或②),请举一例说明该条结论不正确,例:_______。
PH﹤7 PH=7 PH﹥7 ①② 甲 乙同学先用蒸馏水将PH试纸润湿了 丙同学将PH试纸直接浸入硫酸铵溶液中 乙同学测得的PH偏大; 丙同学会污染硫酸铵溶液 ② 碳酸钠溶液显碱性 【解析】【猜想或假设】溶液可呈现酸性碱性或者中性,故答案为:pH<7;【设计和实验】指示剂可测量溶液的酸碱性但不能测量酸碱度,故答案为:①②;【评价与反思】正确的PH试纸的使用方法是取待测液少许涂与其上进行检验;...查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:科学探究题
某化学兴趣小组按以下方案探究室温时硫酸铵饱和溶液的酸碱度。
【猜想与假设】溶液的pH可能为:①_________,②_________,③________。
【设计与实验】要测定该溶液的酸碱度,不能采用下列物质中的_______(填序号)来进行实验。
①紫色石蕊试液 ②无色酚酞 ③pH试纸
组内同学分别进行如下实验:
甲同学:取pH试纸放在玻璃片上,用干净玻璃棒蘸取硫酸铵溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡对照,测得pH<7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用干净玻璃棒蘸取沾在pH试纸上,把试纸显示的颜色与标准比色卡对照,测得pH<7。
丙同学:将pH试纸直接浸入硫酸铵溶液中,把试纸显示的颜色与标准比色卡对照,测得pH<7。
【评价与反思】三位同学中,操作正确的是____同学,指出其余两位同学操作上的错误:①_____________________________,②_______________________________。造成的后果分别为:①________________________,②__________________________。
【结论与分析】该小组同学根据实验得出以下结论: ①硫酸铵溶液虽然显酸性,但硫酸铵不是酸,而是盐。②凡是盐的溶液都显酸性。
你认为上述结论错误的是第______条(填①或②),请举一例说明该条结论不正确,例:_______。
【答案】 PH﹤7 PH=7 PH﹥7 ①② 甲 乙同学先用蒸馏水将PH试纸润湿了 丙同学将PH试纸直接浸入硫酸铵溶液中 乙同学测得的PH偏大; 丙同学会污染硫酸铵溶液 ② 碳酸钠溶液显碱性
【解析】【猜想或假设】溶液可呈现酸性碱性或者中性,故答案为:pH<7;【设计和实验】指示剂可测量溶液的酸碱性但不能测量酸碱度,故答案为:①②;【评价与反思】正确的PH试纸的使用方法是取待测液少许涂与其上进行检验;【结论与分析】测得溶液的pH<7,说明硫酸铵的溶液呈酸性;并不是所有的溶液都是中性的,碳酸钠的溶液就呈碱性。
【题型】科学探究题
【结束】
18
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:__________________。
【实验与探究】
(1)实验如下:
实验操作步骤 | 实验现象 | 结论及解释 |
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸。 | 实验过程中始终没有气泡产生。 | 则证明猜想______成立。 |
步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 | 实验过程中产生_______。 | 则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为__________________。 |
(2)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈________性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是______________________。
(3)实验小组的同学展开讨论,又提出了一个定量实验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立。实验如下:准确称取m克固体样品于试管中,加蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反应后过滤、洗涤、干燥称得沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)___________________;若猜想Ⅲ成立,则m与n的关系式又为_________________________。
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示):
__________________________________________________________。
NaOH和Na2CO3 Ⅰ 白色沉淀 BaCl2+Na2CO3=BaCO3↓+2NaCl 碱 滴加过量的氯化钡溶液 n =197m/106( 或n=1.86m或m=106n/197或m=0.54n) 0查看答案和解析>>
科目: 来源:广东省2017届九年级下学期第一次模拟考试化学试卷 题型:填空题
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:__________________。
【实验与探究】
(1)实验如下:
实验操作步骤 | 实验现象 | 结论及解释 |
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸。 | 实验过程中始终没有气泡产生。 | 则证明猜想______成立。 |
步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。 | 实验过程中产生_______。 | 则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为__________________。 |
(2)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈________性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是______________________。
(3)实验小组的同学展开讨论,又提出了一个定量实验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立。实验如下:准确称取m克固体样品于试管中,加蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反应后过滤、洗涤、干燥称得沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)___________________;若猜想Ⅲ成立,则m与n的关系式又为_________________________。
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示):
__________________________________________________________。
【答案】 NaOH和Na2CO3 Ⅰ 白色沉淀 BaCl2+Na2CO3=BaCO3↓+2NaCl 碱 滴加过量的氯化钡溶液 n =197m/106( 或n=1.86m或m=106n/197或m=0.54n) 0<n< 197m/106(或0<n< 1.86m) CO2+2NaOH=Na2CO3+H2O
【解析】【猜想与假设】固体可能全部是NaOH,也可能全部是Na2CO3,也可能是NaOH和Na2CO3;【实验与探究】(1)取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸,没有气泡产生,说明不含碳酸钠;猜想Ⅰ成立;取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液,产生白色沉淀,说明含碳酸钠;则证明猜想Ⅱ或Ⅲ成立;碳酸钠和氢氧化钡反应的化学方程式为:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;(2)碳酸钠溶液呈碱性,能使酚酞变红,因此,该方案的操作步骤中应该改进的是:继续滴加氯化钡溶液至过量,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立;(3)设碳酸钠的质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
x ng

x= ng
ng
若猜想Ⅱ成立,则m与n的关系式为: 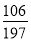 ng=mg;即
ng=mg;即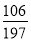 n=m;
n=m;
若猜想Ⅲ成立,则m与n的关系式为: 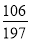 ng<mg,即
ng<mg,即 n<m,
n<m,
【反思与交流】氢氧化钠和二氧化碳反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O。
【题型】科学探究题
【结束】
19
用下列物质的化学式填空:
①氢氧化钠 ②氢氧化铝 ③消石灰 ④稀硫酸
(1)可用于金属表面除锈的是___________;(2)用来治疗胃酸过多的是_____________;
(3)在农业上常用来改良酸性土壤的是___________;
H2SO4 Al(OH)3 Ca(OH)2 【解析】(1)稀硫酸具有酸性,可以除去铁锈;(2)氢氧化铝呈碱性,可以用来中和胃酸;(3)氢氧化钙具有碱性,常用于改良酸性土壤。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com