
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
下列实验操作正确的是 ( )
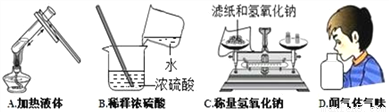
A. A B. B C. C D. D
A 【解析】A、加热试管中的液体时,液体的量不能超过试管容积的三分之一,且要用外焰加热,先均匀加热,后对准药品固定加热。试管口向上倾斜,与桌面呈45°角,正确;B、稀释浓硫酸,应将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌,使热量及时扩散,错误;C、称量氢氧化钠时,应将药品放入小烧杯中,防止腐蚀托盘,错误;D、闻气体气味时,应该用手在瓶口轻轻扇动,使少量气体进入鼻孔闻气味,错误。故选A。 ...查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
下列有关的化学用语表达正确的是( )
A. 五个氢原子:H5 B. 三个水分子:3H2O
C. 四个钙离子:2Ca+2 D. 四个铵离子:4NH3+
B 【解析】A、原子的表示方法:直接用元素符号就能表示一个原子,氢原子是H,5个氢原子表示为5H,错误;B、标在化学式前面的数字表示分子的个数,故3个水分子表示为3H2O,正确;C、根据离子的表示方法:在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,由于1个钙离子带2个单位正电荷,故可表示为Ca2+,4个钙离子就在其前再加4...查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
分类法是化学研究的重要方法。以下分类不正确的是
A. 合金:生铁、青铜、硬铝 B. 氧化物: 水、二氧化锰、五氧化二磷
C. 碱: 纯碱、生石灰、苛性钠 D. 合成材料:塑料、合成橡胶、合成纤维
C 【解析】A、合金,是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,生铁是含碳的铁合金;青铜是铜和锡的合金;硬铝是铝、铜、镁、硅的合金,故A正确;B、氧化物是由两种元素组成,并且有一种元素为氧元素的化合物,所以水、二氧化锰、五氧化二磷均属于氧化物,故B正确;C、碱是指电离时产生的阴离子全部是氢氧根离子的化合物,而碳酸钠是由钠离子与碳酸根离子构成的化合物,属于盐,故C错...查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
大蒜中含有的一种有效成分“硫化丙烯”(C3H6S)具有一定的杀菌食疗作用。下列有关硫化丙烯的说法正确的是( )
A. 硫化丙烯的相对分子质量为74 B. 硫化丙烯分子中碳、氢、硫元素质量比为3:6:1
C. 硫化丙烯中硫元素质量分数最大 D. 硫化丙烯是由3个碳原子、6个氢原子和1个硫原子构成
A 【解析】A、硫化丙烯的相对分子质量为12×3+1×6+32=74,正确;B、硫化丙烯中碳元素、氢元素和硫元素的质量比为(12×3):(1×6):32≠3:6:1,错误;C、硫化丙烯中碳元素、氢元素和硫元素的质量比为(12×3):(1×6):32,可见其中碳元素质量分数最大,错误; D、1个硫化丙烯分子是由3个碳原子、6个氢原子和1个硫原子构成的,错误。故选A。查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
A 和 B 反应生成 C 和 D 的微观示意图如图所示:
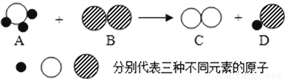
则下列说法正确的是 ( )
A. 该化学反应属于置换反应
B. 恰好完全反应时,反应前后各原子种类不变,数目减少
C. 反应前后三种元素的化合价都没有改变
D. 恰好完全反应时 A 与 B 两物质的化学计量数之比为 1:1
A 【解析】A. 一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应;该化学反应属于置换反应,正确;B. 化学反应的实质是旧的分子分子分成原子,原子再重新组合成新的分子,反应前后各原子种类、数目、质量都不变,错误;C. 单质中元素的化合价为零,化合物中元素的化合价代数和为零,反应前后对应元素的化合价都发生了改变,错误;D. 据质量守恒定律可知反应前后原子的种类个数不变,恰好完全...查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
下列依据实验目的所设计的实验方案中,正确的是( )
选项 | 实验目的 | 实验方案 |
A | 除去NaCl溶液中的Na2CO3 | 加适量稀硫酸 |
B | 除去CaO中的CaCO3 | 加水溶解,过滤 |
C | 除去CO2中的HCl气体 | 将混合气体通入NaOH溶液 |
D | 除去KNO3溶液中的KCl | 加适量的AgNO3溶液,过滤 |
A. A B. B C. C D. D
D 【解析】A、碳酸钠和稀硫酸反应会生成硫酸钠,硫酸钠对于氯化钠也是杂质,故A错误; B、氧化钙会与水反应生成氢氧化钙,除去了主要物质,故B错误; C、二氧化碳、氯化氢都会与氢氧化钠反应,不能进行除杂,故C错误; D、氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,除去了氯化钾,没有引入新的杂质,故D正确。查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:单选题
下列图象正确的是( )
A. 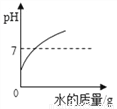 稀释浓硫酸
稀释浓硫酸
B.  电解水一段时间
电解水一段时间
C. 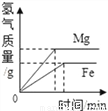 等质量的 Mg 和 Fe 与足量同浓度稀盐酸反应
等质量的 Mg 和 Fe 与足量同浓度稀盐酸反应
D.  浓盐酸露置空气中
浓盐酸露置空气中
查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:填空题
化学与生活息息相关。
(1)蒸鸡蛋是一道非常适合考生的补脑食品,鸡蛋中的鸡蛋清主要含有的基本营养素是_________。
(2)碘元素是人体必需的微量元素,缺乏碘元素会引起_____。
(3)炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是_____________。
(4)洗涤剂可用来洗碗,是因为它对油污具有_____功能。
(5)常温下,铝制品耐腐蚀不易生锈的原因是_____。(用化学方程式表示)
蛋白质 甲状腺肿大(或大脖子病) 隔离可燃物 乳化 4Al+3O2=== 2Al2O3 【解析】(1). 鸡蛋中的鸡蛋清主要含有的基本营养素是蛋白质 ; (2). 缺乏碘元素会引起甲状腺肿大(或大脖子病),少儿缺碘易导致呆小症; (3). 燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破...查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:填空题
在分子、原子的微观层面上研究物质及其化学反应是化学学科的特点。请回答:
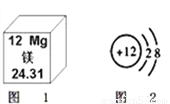
(1)如图 1,镁的相对原子质量为 _____。
(2)如图 2,表示的粒子属于 _____(填“原子”、“阳离子”或“阴离子”)。
(3)某反应的化学方程式为4X+11O2 2Fe2O3+8SO2,可推断 X 的化学式为 _____;
2Fe2O3+8SO2,可推断 X 的化学式为 _____;
查看答案和解析>>
科目: 来源:福建省2018届初三第二学期期中考试化学试卷 题型:填空题
氯化钠在生活、生产中有广泛的用途。
Ⅰ.在农业生产上,常需要用质量分数为16%的氯化钠溶液选种。某同学配制100g质量分数为16%的氯化钠溶液,需要氯化钠的质量为________g;水的体积为______mL(水的密度近似看作1g/cm3)。
Ⅱ.海水中提取氯化钠。利用风吹日晒可以从海水中提取粗盐,粗盐中一般含有少量泥沙等杂质。以下是制备纯净氯化钠的实验流程,请据图回答问题。
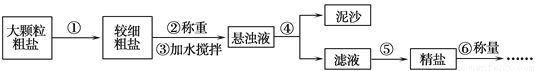
(1)操作⑤中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、________。其中玻璃棒的作用是___________________。
(2)实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,其可能的原因是____(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.过滤时滤纸有破损
(3)如图是甲、乙两种固体物质的溶解度曲线。
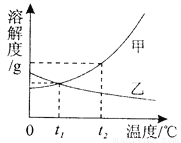
①_______℃时,甲、乙两种物质的溶解度相等。
②t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:
甲______乙(填“>”、“<”或“=”)。
Ⅲ. 家庭制备氯化钠: 将洁厕灵(含有盐酸)与炉具清洁剂(含有氢氧化钠)混合,如下图甲所示。
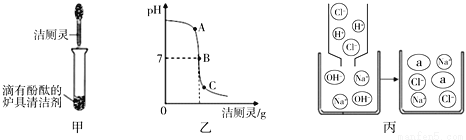
①若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____________,此时溶液可用图乙中______(选填A、B、C)点处表示。
②若反应后溶液pH为7,图丙中a微粒的化学式为_________。
16 84 蒸发皿 搅拌,防止因局部温度过高造成液体飞溅 AB t1 < NaOH 、NaCl A H2O 【解析】 (1). 配制100g质量分数为16%的氯化钠溶液,需要氯化钠的质量为100g×16%=16g;水的体积为100g-16g= 84g,即84mL; (3). 蒸发时中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、蒸发皿。其中玻璃棒的作用是搅拌,使液体受热均匀,防止因局部温度过高...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com