
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:null
推理是一种重要的学习方法.下列推理中正确的是( )
A. MnO2是加快H2O2分解的催化剂,因此催化剂是加快化学反应速率的物质
B. 单质是由一种元素组成的,因此一种元素组成的纯净物一定是单质
C. 氧化物中含有氧元素,因此含有氧元素的纯净物一定是氧化物
D. 分子是构成物质的粒子,因此物质都是由分子构成的
B 【解析】A、MnO2是加快H2O2分解的催化剂,但并不是所有的催化剂都是加快化学反应速率的物质,故A错误;B、单质是指由一种元素组成的纯净物,所以单质是由一种元素组成的,因此由一种元素组成的纯净物一定是单质,故B正确;C、含有氧元素的纯净物不一定是氧化物,例如氯酸钾中含有氧元素就不是氧化物,故C错误;D、分子是构成物质的微粒,但是物质不都是由分子构成,还有原子和离子,故D错误。故选B。 ...查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:单选题
在密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,并测得反应前后各物质的质量如表所示:下列说法错误的是()
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 10 | 4 | 30 | 22 |
反应后质量/g | 待测 | 13 | 38 | 5 |
A. 反应后甲的质量为0g
B. 甲可能是该反应的催化剂
C. 乙、丙变化的质量比为9:8
D. 该反应是分解反应
A 【解析】A、根据反应前后物质的总质量不变,反应后甲的质量=10g+4g+30g+22g?13g?38g?5g=10g,反应后甲的质量是10g,错误;B、甲的质量反应前后没有变化,可能没有参加反应,也可能是催化剂。正确;C、乙的质量增加了(13g-4g)=9g;丙的增加质量为(38g-301g)=8g,所以乙、丙的变化质量比为9:8,正确;D、反应后丁的质量减少,是反应物,乙、丙的质量增加...查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:填空题
填写化学符号或化学符号表示的意义
化学符号 | ____ | _______ |
| NO3- | _______ | ||
表示意义 | 氖气 | 三个铁离子 | _______ | _______ | 2个氮气分子 |
查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:填空题
事物之间存在联系,找出联系、发现规律是我们学好化学的一种基本方法。
(1)结构决定性质。研究发现含有“过氧基(—O—O—)”的物质具有很强的氧化性,可以作杀菌消毒剂。据此推测,下列物质中,可用作杀菌消毒剂的是 (填数字序号)。
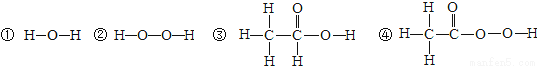
(2)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:
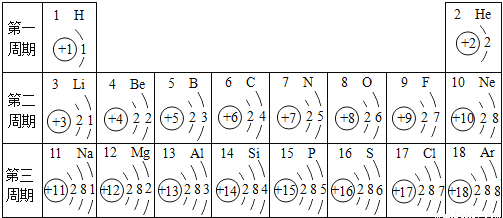
在第3周期中,各原子核外电子排布的变化规律是 。
(3)能将下列物质:“空气、氧气、水蒸气、二氧化碳、高锰酸钾、铁粉、氮气、氧化铁”中的“氧气、铁粉、氮气”分为一类的依据是 。
(4)X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则w克XY2中含有Y的原子数是 。
(5)A、B、C、D、E、F均为初中化学常见的物质,且均含一种地壳中含量最多的元素,其中A是单质;B、C在常温下均为液体,且组成元素相同;E在常温下为气体,有分子构成,能使澄清石灰水变浑浊;反应①中出现火星四射现象。它们之间存在如图所示的转化关系(图中转化条件已略去)。
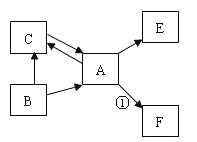
回答有关问题:
①写出B的化学式,并表述显负价元素的化合价: ;
②写出一个属于化合反应的文字表达式或化学方程式 ;
(1)②④;(2)由左向右,最外层电子数由1依次递增到8 (3)都是单质(4) (5)(2H2+O22H2O) 【解析】试题分析:(1)含有“过氧基(—O—O—)”的物质具有很强的氧化性,可以作杀菌消毒剂。②④中含有“过氧基(—O—O—)”可做消毒剂;(2)相对原子质量之比等于原子质量的比,故mg/(M-2A)=一个y原子的质量/A,一个y原子的质量=mA/(M-2A);化合物中...查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:简答题
小宇和同学们在学习化学之后再次走进科技馆,如图所示的连环画记录了他们的参观过程。请据图和叙述回答I-IV题。
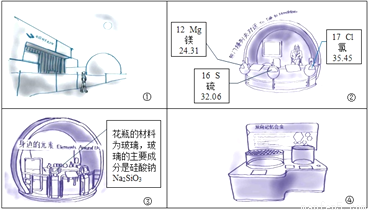
I.今天天气晴朗,空气质量优良。
(1)下列属于空气污染物的是_______(填字母序号).
A. N2B.CO2 C.PM2.5 D.CO
(2)保护人类赖以生存的空气,是每个公民的责任。小宇能做些什么呢?请你给她的出行提出一条建议:_______
II.来到“与门捷列夫对话”展台。看到熟悉的元素周期表,依据图②中显示的信息回答。
(1)氯的相对原子质量为_______
(2)镁元素是核电荷数为_______的一类原子的总称。镁原子原子的结构示意图为: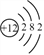 ,在化学反应中易___(填“得”或“失”)电子。
,在化学反应中易___(填“得”或“失”)电子。
(3)写出图②中一种元素的单质与氧气反应的化学方程式_______.
III.“太空探索”展台周围吸引了很多观众。
航天员出舱所穿的宇航服能为其提供氧气,吸收二氧化碳。用于吸收二氧化碳的物质是氢氧化锂,已知其中锂(Li)的化合价为+1,其化学式为_______
IV.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:
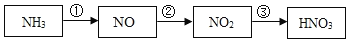
①NH3+O2 →NO+H2O
②NO+O2→NO2
③NO2+H2O→HNO3+NO
(1)上述反应涉及的物质中,属于氧化物的有_______种.
(2)反应②的基本反应类型为_______.
(3)制取硝酸过程中可循环使用的物质是_______
CD 乘公交车出行、植树造林等(答案合理即可) 35.45 12 失 2Mg+O22MgO或S+O2SO2 LiOH 3 化合反应 NO 【解析】本题主要考查了空气污染的防治,元素周期表和原子结构示意图,化学式和化学方程式的书写等。 I、 (1)空气的主要污染物有二氧化硫、二氧化氮、一氧化氮、可吸入颗粒物(PM2.5),故选CD; (2)减少环境污染的主要措施有:乘公交车出行、...查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:综合题
通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: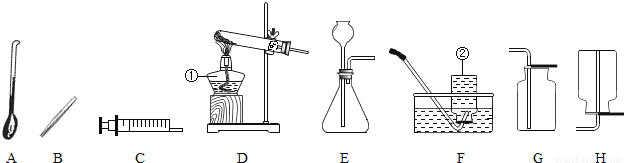
(1)写出图中标示的仪器名称:①___;②___
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
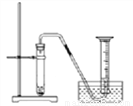
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
酒精灯 集气瓶 D F或G 紫黑色 2KMnO4K2MnO4+MnO2+O2↑ 带火星的木条放在集气瓶口,观察木条是否复燃 分液漏斗(注射器) 过滤 玻璃棒 引流 能溶于水且密度大于空气的性质取 取5mL10%H2O2溶液,记录数据 有 二氧化锰 t1查看答案和解析>>
科目: 来源:江苏省南通市2017-2018学年度九年级第一学期期中考试化学试卷 题型:综合题
黑木耳是一种营养丰富的食用菌,含有人体必需的钙、铁、胡萝卜素、维生素等营养物质,经常食用可补充人体对铁等微量元素的需求。其中营养成分的具体含量如资料卡片所示。请根据资料回答下列问题:

(1)黑木耳中所含的铁是指___(填字母序号).
A. 分子 B.原子 C.元素
(2)硫酸亚铁(FeSO4)是常见补铁类保健品中的有效成分之一,请根据其化学式计算:
①硫酸亚铁的相对分子质量为___,
②硫酸亚铁中铁、硫、氧三种元素的质量比为___;
③与200g干黑木耳中的铁元素质量相等的硫酸亚铁的质量为___ mg.
C 152 7:4:8 532 【解析】本题考查了标签上标示的物质成分及其含量,元素的概念,根据化学式计算。结合标签新信息、灵活运用化学式的有关计算进行分析。 (1)黑木耳中所含的铁不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关; (2)①硫酸亚铁的相对分子质量为56+32+16×4=152; ②硫酸亚铁中铁、硫、氧三种元素的质量比56:...查看答案和解析>>
科目: 来源:2018年广州市南沙区中考一模化学试卷 题型:单选题
厨房里的下列操作中,发生了化学变化的是( )
A. 拉面条 B. 磨豆浆 C. 切黄瓜 D. 酿米酒
D 【解析】试题分析:化学变化是有新物质生成的变化,物理变化是没有新物质生成的变化,二者的本质区别为是否有新物质生成;A.拉面条,没有新物质生成,属于物理变化; B.磨豆浆,没有新物质生成,属于物理变化;C.切黄瓜,没有新物质生成,属于物理变化; D.酿米酒,有新物质生成,属于化学变化;故答案选择D查看答案和解析>>
科目: 来源:2018年广州市南沙区中考一模化学试卷 题型:单选题
下列物质属于盐类的是
A. 丙酸:C2H5COOH B. 氨水:NH3·H2O
C. 氯化铵:NH4Cl D. 熟石灰:Ca(OH)2
C 【解析】A、丙酸电离时生成的阳离子都是氢离子,属于酸,不属于盐,错误;B、氨水在电离时生成的阴离子都是氢氧根离子,属于碱,不属于盐,错误;C、氯化铵是由铵根离子和氯离子组成的化合物,属于盐,正确;D、熟石灰〔Ca(OH)2〕在电离时生成的阴离子都是氢氧根离子,属于碱,不属于盐,错误。故选C。查看答案和解析>>
科目: 来源:2018年广州市南沙区中考一模化学试卷 题型:单选题
在A+3B==2C+2D的反应中,14gA完全反应生成44gC和18gD,若A的相对分子质量为28, 则B的相对分子质量是
A. 16 B. 32 C. 64 D. 96
B 【解析】试题分析:根据质量守恒定律知道参加反应的B的质量为48克,设B的相对分子质量为X。 A + 3B 2C+2D 28 3X 14克 48克 列比例式得:28:14克=3X:48克 解得X=16。故选A.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com