
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:单选题
除去下列各组物质中的杂质,所用试剂和方法均正确的是:
物质 | 杂质 | 除杂所用试剂和方法 | |
A | O2 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
B | NaOH溶液 | Ca(OH)2溶液 | 先加入过量Na2CO3的溶液,再过滤 |
C | NaCl | Na2CO3 | 加入澄清的石灰水,过滤 |
D | CaO | CaCO3 | 加入适量的稀盐酸,蒸发 |
A. A B. B C. C D. D
A 【解析】试题分析∶除杂原则(1)尽量把杂质除净。(2)在除去杂质的同时不要增添新的杂质。A.HCl气体与NaOH溶液反应,浓硫酸具有吸水性,故A正确。B.过量的Na2CO3溶液,故B错误。C.生产氢氧化钠,故C错误。D.稀盐酸与CaO,CaCO3 均反应,故D错误。查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:单选题
有四种溶液:、①、氢氧化钠溶液;②硫酸钠溶液;③稀硝酸;④氯化铁溶液,不用其他试剂就可将它们逐一鉴别出来,其正确顺序是
A. ④①③②; B. ④②①③; C. ④③②① ; D. ①③②④
A 【解析】这四种物质中,④氯化铁溶液为黄色,其它三种物质的溶液为无色,所以首先鉴别出④氯化铁溶液;将④氯化铁溶液滴加到其它三种物质中时,能得红褐色沉淀的是①氢氧化钠。由于稀硝酸呈酸性可以和碱反应,所以可以将剩余的两种溶液分别和生成的氢氧化铁反应,稀硝酸酸可使其溶解。因此鉴别出各物质的顺序是④①③②,故选D。查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:单选题
实验中除杂的思路有两种:一是将杂质除去,二是将有用物质提取出来,以下除杂方法与后者的思路一致的是( )
A. 实验室用蒸馏的方法制取蒸馏水
B. 用灼热的铜网除去N2中混有的少量O2
C. 加热蒸发法除去氯化钠溶液中混有的少量盐酸
D. 用适量石灰石除去氯化钙溶液中混有的少量盐酸
A 【解析】试题分析:A、实验室用蒸馏的方法制取蒸馏水,是加热水沸腾,不断挥发,再冷凝得到蒸馏水,是利用了将有用物质提取出来的原理,正确,B、用灼热的铜网除去N2中混有的少量O2,发生的反应:2Cu + O2△2CuO,是将杂质除去,错误,C、盐酸的溶质是气体氯化氢,故加热蒸发法除去氯化钠溶液中混有的少量盐酸,是将杂质除去,错误,D、用适量石灰石除去氯化钙溶液中混有的少量盐酸 ,发生反应:C...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:填空题
用化学用语填空:
(1)一个钾原子:______; (2)氖气:________ ; (3)3个铁离子:_________ ;
(4)2个水分子:______; (5)碳酸:___________ (6)标出氯化铵中N的化合价:_________ 。
K Ne 3 Fe3+ 2 H2O H2CO3 【解析】(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字;(2)氖气是由氖原子直接构成的,用元素符号表示其化学式;(3) 离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其符号前加上相应的数字; (4)...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:填空题
化学知识与生活联系密切。请用下列物质的序号填空。
①食醋 ②石墨 ③酒精 ④活性炭 ⑤食盐
(1) 除去冰箱异味______ , (2)可用作汽车燃料_______ , (3)腌制鱼肉等常用的调味品_______ , (4) 用作干电池电极_______ ,(5) 除去铝壶中的水垢_____ 。
④ ③ ⑤ ② ① 【解析】分析:(1)根据活性炭的吸附性判断. (2)根据酒精的可燃性判断. (3)根据食盐的成分和氯化钠有咸味判断. (4)根据石墨的导电性判断. (5)根据碳酸钙与醋酸反应生成可溶的醋酸钙、水、二氧化碳的性质判断. 解答:【解析】 物质的用途主要取决于物质的性质. (1)活性炭有吸附性,能吸附色素和异味,所以正确. (2)酒精...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:简答题
化学就在我们身边,它与我们的生活息息相关.
(1)请从“碳酸钙、硫酸、熟石灰、硝酸钾”四种物质中选择适当的物质填空:(写化学式)
①可用于配制波尔多液的是______________;②工业上用于金属除锈的是_____________;
③日常生活中用作复合肥的是____________;④用作补钙剂的是______________。
(2)现有H、Cl、O、Na四种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示):
①日常生活中常用的调味品______________;②炉具清洁剂中含有的一种碱______________;
③常见的一种溶剂______________; ④实验室里经常用到的一种酸______________。
(3)用化学方程式解释下列问题:
①生石灰做食品干燥剂___________________________________;
②稀盐酸除去铁制品表面的锈_________________________________________;
③正常雨水的pH为5.6_____________________________________;
④用小苏打治疗胃酸过多____________________________________________。
Ca(OH)2 H2SO4 KNO3 CaCO3 NaCl NaOH H2O HCl CaO +H2O = Ca(OH)2 Fe2 O3+6HCl=2 FeCl3 +3H2O CO2 + H2O= H2CO3 NaHCO3+HCl= NaCl+H2O+ CO2↑ 【解析】(1)首先要熟记常见物质的性质和用途,根据性质和用途选出正确物质,再正确写出其化学式;(2)首先根据题意确定物质的化学名称...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:实验题
水在化学实验中的作用不可忽视。下图中五个实验分别用到水。

请回答:
⑴实验A中水作______(填“溶剂”或“溶质”),其中玻璃棒的作用是_______________。
⑵实验B中水的作用是__________________________。
⑶实验C中反应的化学方程式是_____________;通过烧杯中的水进入集气瓶中的体积可得出氧气约占空气总体积__________的结论,若小于理论值,可能的原因之一是_________________
⑷实验D中水的作用是提供热量和________________。
⑸实验E中的集气瓶里装满水的目的是__________________。
溶剂 搅拌,加速溶解 防高温熔化物溅落炸裂瓶底 4P+5O22P2O5 1/5 红磷量不足(装置气密性不好等合理即可) 隔绝空气 排尽瓶内空气 【解析】⑴根据物质溶于水时,水做溶剂分析,玻璃棒主要作用是搅拌,加速溶解解答;⑵根据铁丝在氧气中燃烧会产生大量的热使铁丝熔融溅落,瓶底的水能防止溅落的熔融的铁丝炸裂集气瓶分析;⑶根据红磷与氧气在点燃的条件下反应生成五氧化二磷解答;根据空气中的氧气约占...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:科学探究题
兴趣组学生海边盐场参观,带回了部分粗盐样品,并对其进行了如下图探究:
(1)操作③的名称是______。
(2)操作③④中均用到玻璃棒,其作用分别为__________,_________。
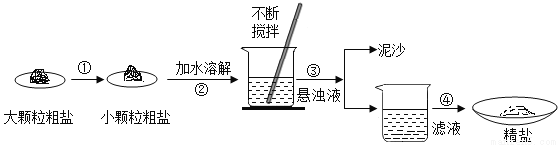
(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有______(填序号)
①氯化钠固体不纯 ②称量时精盐与砝码放反了 ③量取水时俯视读数 ④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:

①白色沉淀的化学式为______.
②在得到的滤液中加入足量的稀盐酸的目的是______________________________.
③若实验过程中不考虑损耗,最终得到的NaCl固体的质量将______(填“大于”、“小于”或“等于”)原精盐中NaCl的质量.
过滤 引流 搅拌使均匀受热,防局部过热导致液滴飞溅。 ①② Mg(OH)2 除去过量的NaOH溶液 大于 【解析】(1)根据过滤可以将不溶物和可溶物分离分析解答;(2)根据玻璃棒在过滤时的及蒸发时作用进行分析;(3) 根据氯化钠溶液的质量分数偏小,可能是氯化钠质量少了,也可能是水的质量多了进行分析;(4) ①根据氢氧化钠和氯化镁会生成氢氧化镁沉淀进行分析;②根据除去氯化镁加入的氢氧化钠是过量...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:科学探究题
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡。
现象:溶液变成浅红色.由此得出结论①__________________________;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为②_____________________;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如下所示装置进行实验

现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,清石灰石变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).步骤③______________________,现象④_________________________。
(2)写出碳酸氢钠受热分解的化学方程式⑤________________________________________
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途⑥___________________________。
NaHCO3溶液显碱性 固体溶解,有大量气泡产生 取样,加水溶解滴加氯化钙(氯化钡)溶液 有白色沉淀产生 2NaHCO3 Na2CO3+CO2↑+ H2O 治疗胃酸过多(合理即可) 【解析】(1). 酚酞试液是常用的酸碱指示剂,遇碱性溶液变红,遇酸性或中性溶液不变色;向碳酸氢钠溶液中滴入几滴酚酞,试液变成红色,说明碳酸氢钠溶液呈碱性 ; (2). 碳酸氢钠也盐酸反应生成氯化钠、二氧化碳、水,...查看答案和解析>>
科目: 来源:湖南省常德外国语学校2018届九年级下学期期中考试化学试卷 题型:综合题
正常情况下人的胃液pH为0.8—1.5,相应含氯化氢的质量分数为0.2%—0.4%,胃液中氯化氢过多过少都不利于健康。某人出现反胃、吐酸水的症状,经检查其胃液中氯化氢的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_________性。
(2)若人的胃液总量为100mL,正常胃液中HCl的质量范围为___________________ g。
(3)服用碱性物质可以治疗胃液中HCl含量过多,你认为该患者 ___________ (填能或不能)服用熟石灰来治疗胃酸过多,理由是 ______________________________________ 。
(4)医生给患者开的药是胃舒平[有效成分是Al(OH)3],每片胃舒平含Al(OH)3 的质量为0.39g。请根据化学方程式计算该患者至少服用________片胃舒平,胃液才能恢复正常? (请写出计算过程)
酸性 0.2—0.4g 不能 因为氢氧化钙有腐蚀性。 该患者至少服用2片胃舒平,胃液才能恢复正常。 【解析】(1) 根据正常情况下人的胃液pH为0.8—1.5解答; (2)根据胃液的体积、密度、含HCl的溶质质量分数可以计算氯化氢的质量范围;(3)根据氢氧化钙有腐蚀性分析解答;(4) 根据化学方程式可以计算服用胃舒平的片数。(1) 正常情况下人的胃液pH为0.8—1.5,小于7,显酸性;(2...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com