
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:填空题
能源问题是人们关注的重要主题。
(1)当前人们使用的能源主要是不可再生的化石燃料,包括煤、石油和________等。
(2)氢气作为清洁能源,越来越受到人们的关注。在光照条件下,利用含有石墨烯的催化剂,可使水分解生成氢气和氧气,该反应的化学方程式为_________。
天然气 )2H2O 2H2↑+ O2↑ 【解析】(1)不可再生的三大化石燃料是煤、石、天然气; (2)水在石墨烯作催化剂光照的条件下反应生成氢气和氧气,反应方程式为:2H2O 2H2↑+ O2↑;查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:简答题
从1世纪起,铁便成了一种最主要的金属材料。

(1)上述三种铁矿石的主要成分属于氧化物的是__________。
(2)工业上用一氧化碳和赤铁矿炼铁的原理是__________(用化学方程式表示)。
Fe2O3、Fe3O4 (或写氧化铁、四氧化三铁等物质名称) Fe2O3 + 3CO 2Fe + 3CO2 【解析】(1)赤铁矿和磁铁矿中的主要成分是氧化物,分别是Fe2O3、Fe3O4; (2)工业上用一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应方程式为Fe2O3 + 3CO 2Fe + 3CO2查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:填空题
农业上常用溶质的质量分数为16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。

(1)若需要配制100 g 16%的氯化钠溶液,需要氯化钠的质量为________g。
(2)室温下氯化钠的溶解度约为36 g。上述选种用的氯化钠溶液是_________(填“饱和”或“不饱和”)溶液。
16g 不饱和 【解析】(1)100 g 16%的氯化钠溶液中溶质的质量为=16g (2)室温下氯化钠的溶解度约为36 g,故向100g的水中加入16g的氯化钠所得的溶液是不饱和溶液;查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:科学探究题
阅读下面科普短文(原文作者:王龙飞等,有删改)。
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
生产中大量使用的臭氧通常由以下方法制得。

臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表所示。
表 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2 mg/L) | 二次污染 | 投资成本 (900 m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | < 5 min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | > 30 min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)臭氧的相对分子质量为_________。
(2)臭氧处理饮用水时,利用了臭氧的_________(填“物理”或“化学”)性质。
(3)臭氧转化为氧气的微观示意图如下,请在方框中补全相应微粒的图示。


(4)为了快速杀灭病毒,应选择的消毒剂是__________。
(5)下列关于臭氧的说法中,正确的是________。
A.臭氧的漂白作用比氯气强
B.由氧气制得臭氧的过程中,既有物理变化也有化学变化
C.臭氧在生产生活中有很多用途,对人类有益无害
D.臭氧稳定性差,不利于储存,其应用可能会受到限制
48 化学 臭氧 【解析】(1)臭氧的相对分子质量为1648; (2)臭氧具有强氧化性,可以杀死细菌和病毒,故臭氧处理饮用水时,利用了臭氧的化学性质; (3)2个臭氧分子中含有6个氧原子,故可以分解得到3个氧气分子,用微观示意图表示为 (4)臭氧可以快速的杀灭一切微生物,包括细菌、病毒、芽孢等,故选臭氧; (5)A、实践证明,臭氧的漂白作用是氯气的15倍之多。正确; ...查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:综合题
NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。
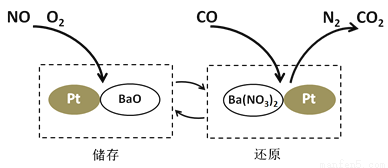
(1)储存时,部分NO和O2在一定条件下发生化合反应生成NO2,该反应的化学方程式为___________;吸收NOx(如NO、NO2)的物质是___________。
(2)还原时,存在如下反应:
5CO + Ba(NO3)2 N2 + BaO + 5CO2
N2 + BaO + 5CO2
①反应中,碳元素的化合价__________(填“升高”或“降低”)。
②若有28 g CO参与反应,则生成CO2的质量为________g。
2NO+O2 2NO2 ; BaO 升高; 44 【解析】(1)NO和O2在一定条件下发生化合反应生成NO2,该反应的化学方程式为2NO+O2 2NO2 ;吸收NOx(如NO、NO2)的物质是.BaO; (2)①一氧化碳中碳元素的化合价为+2价,反应后二氧化碳中碳元素的化合价为+4价,故碳元素的化合价升高; ②设生成二氧化碳的质量为x 5CO + Ba(NO3)2N2 + ...查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:简答题
根据下图从A或B两题中任选一个作答,若两题均作答,按A计分。
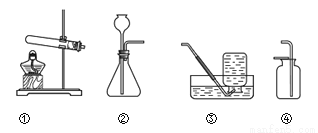
A | B |
(1)选用装置①制氧气的化学方程式为____________。 (2)选用装置③收集氧气的理由为____________。 | (1)选用装置②制二氧化碳的化学方程式为___________。 (2)选用装置④收集二氧化碳时,检验气体是否集满的操作是___________。 |
查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:实验题
用下图所示的装置探究“燃烧的条件”及“灭火的原理”。
已知:白磷的着火点为40℃,红磷的着火点为240℃。

(1)实验甲:用可燃物红磷和白磷进行探究,若要证明可燃物燃烧需要与氧气接触,则固体A为_______。
(2)实验乙:将长短两只蜡烛固定在烧杯中,点燃。
①向烧杯中放入干冰后,长蜡烛继续燃烧,短蜡烛的火焰逐渐变小至熄灭。短蜡烛熄灭的原因是_______________。
②向烧杯中继续加入干冰,长蜡烛仍然不熄灭。这一现象反映出CO2具有的性质是___________________。
白磷 隔绝了空气(或干冰升华吸热,温度降低到石蜡的着火点以下) 密度比空气大 【解析】(1)根据控制变量法,水中的物质是白磷; (2)①干冰升华二氧化碳气体使蜡烛隔绝了氧气,故下面的两种熄灭; ②该实验说明二氧化碳的密度比空气的密度大;查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:实验题
化学小组同学用下图所示装置做了2个兴趣实验。
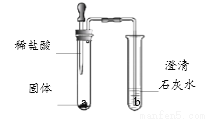
(1)若观察到a中固体减少,有大量的气泡产生,b中溶液无明显变化。推测固体可能是下列物质中的_____(填字母序号)。
A.银 B.锌 C.氢氧化钙 D.碳酸钙
(2)若固体为碳酸氢钠粉末,则整个装置中可观察到的现象有_______________。
B a中产生大量气泡,b中澄清石灰水产生白色浑浊 【解析】(1)b中无明显现象,说明a中没有二氧化碳气体生成;A、银不与稀盐酸反应,错误; B、锌与稀盐酸反应生成氢气,正确; C、氢氧化钙与稀盐酸反应,没有气体生成,错误; D、碳酸钙与稀盐酸反应b中的澄清石灰水变浑浊,错误。故选B。 (2)碳酸氢钠可以与稀盐酸反应冒出大量的气泡,生成的二氧化碳气体使b中的澄清石灰水变...查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:简答题
小明同学用下图所示装置进行实验。甲瓶中充满二氧化碳气体,注射器中装有氢氧化钠浓溶液,乙中盛有足量稀盐酸。小明先关闭止水夹,然后将氢氧化钠浓溶液全部注入甲瓶,一段时间后再打开止水夹。

(1)注入氢氧化钠浓溶液后,甲中发生反应的化学方程式为_____________。
(2)打开止水夹,可观察到的现象有_____________、_____________。
2NaOH + CO2Na2CO3 + H2O 乙中液体倒吸入甲中, 甲中产生无色气体 【解析】(1)氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,反应方程式为2NaOH + CO2Na2CO3 + H2O ; (2)由于氢氧化钠与二氧化碳反应,使瓶内的气体含量减少,内压将低,故打开止水夹后,有液体倒流溶液集气瓶中,流入的稀盐酸与生成的碳酸钠反应,生成二氧化碳气体,故又可以看到有无色气体产...查看答案和解析>>
科目: 来源:北京市海淀区2018年九年级第二学期期中练习 题型:科学探究题
某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。

(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。
氯化物能加快铁钉生锈的速率 CuCl2 + Fe FeCl2 + Cu 稀盐酸或稀硫酸 略 检验红色沉淀中是否含有铜 Cu和Fe2O3 当氯化物能与铁钉反应(置换生成金属)时,可能加快铁钉生锈速度(或其它合理答案) 【解析】(1)由题可知,铁在蒸馏水中的生锈速度比在氯化物溶液中的生锈速度慢,故可以说明氯化物能加快铁钉生锈的速率; (2)铁的活动性比铜强,故铁可能与氯化铜反应,生成红色的...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com