
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:单选题
向 MgSO4和CuSO4的混合溶液中加入一定质量的铁粉,充分反应后过滤,得滤液和滤渣。向滤渣中加入稀盐酸,有气泡产生。根据上述实验得出的下列推断不正确的是
A. 滤液的颜色为浅绿色 B. 滤液中含Fe2+和Mg2+ C. 滤渣含有铁和铜 D. 滤渣的质量小于加入铁粉的质量
D 【解析】在金属活动性顺序中,铜、镁、铁的活动性顺序为镁>铁>铜。所以向MgSO4和CuSO4的混合溶液中投入一定质量铁粉,能发生铁与硫酸铜溶液的反应,铁与硫酸铜反应生成硫酸亚铁和铜,铁不能与MgSO4反应,根据“向滤渣中加入足量的稀盐酸,有气泡产生”,说明铁过量。A、向滤渣中加入稀盐酸,有气泡产生,则说明固体中一定含有铁,说明硫酸铜与铁已经完全反应,滤液的颜色为浅绿色,正确;B、根据分析...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:单选题
通过观察下列实验现象,不能达到实验目的的是

A. 图1观察木条能否复燃,检验是否为氧气 B. 图2观察烧杯内壁变浑浊,判断甲烷中含有氢元素
C. 图3观察石蕊溶液变红,说明分子在不断地运动 D. 图4观察燃烧先后顺序,比较可燃物着火点的高低
B 【解析】A、氧气具有助燃性,能使带火星的木条复燃,观察木条能否复燃可以检验是否为氧气,正确;B、烧杯内壁变浑浊,说明甲烷燃烧时生成了二氧化碳,根据质量守恒定律,判断甲烷中含有碳元素,错误;C、石蕊溶液变红,说明分子是不断运动的,正确;D、观察燃烧先后顺序可以比较可燃物的着火点,其中着火点低的先燃烧,正确。故选B。查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:单选题
CaSO4固体受热时可分解为CaO,其化学方程式为 a CaSO4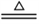 bCaO+ cSO2↑+dX↑。取2.72 g CaSO4充分加热,使之完全分解。将产生的气体通过碱石灰(CaO和NaOH的的固体混合物),碱石灰增重1.28g;再通过灼热的铜网,铜网增重0.32g。则下列说法正确的是
bCaO+ cSO2↑+dX↑。取2.72 g CaSO4充分加热,使之完全分解。将产生的气体通过碱石灰(CaO和NaOH的的固体混合物),碱石灰增重1.28g;再通过灼热的铜网,铜网增重0.32g。则下列说法正确的是
A. 剩余固体的质量为1.44g B. SO2的质量为1.6g C. X化学式可能是SO3 D. 方程式中a:c=1:1
D 【解析】A、根据质量守恒定律可知,剩余固体的质量为2.72g-1.28g-0.32g=1.12g,错误; B、碱石灰增重1.28g,增加的是二氧化硫的质量,SO2的质量为1.28g,错误; C、2.72 g CaSO4中硫元素的质量=2.72g××100%=0.64g,1.28g SO2 中硫元素的质量=1.28g××100%=0.64g,根据质量守恒定律元素的质量在化学反应...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:简答题
宏观和微观相结合是认识物质结构的有效方法之一。
(1)1~18号元素原子最外层电子数与原子序数的关系如下图。X、Y、Z、W表示的元素分别为O、Mg、Al、Cl,试回答下列问题:

①单质W2与单质Y的反应中,Y原子______ (填“得到“成“失去”)电子,其形成的离子符号为_____________。
②X、Z形成的化合物为______(填物质名称)。
③原子序数分别为2和10的原子最外层电子数不一样,但在元素周期表中都处于同一族,从原子结构上分析其原因:____________
(2)下图为Zn和 NaHSO4溶液反应的微观示意图,回答下列问题:

①实际与Zn反应的粒子是____________
②写出烧杯中发生反应的化学方程式:_________________
失去 Mg2+ 三氧化二铝(或填氧化铝) 最外层都是相对稳定结构(或最外层电子数都填满) H+ Zn +2NaHSO4 = ZnSO4 + Na2SO4 + H2↑ 【解析】本题考查了原子核外电子排布,化学反应的微观模拟示意图。解题的关键是依据原子核外电子排布的规律、化学反应的实质并结合图示依据相关的知识进行分析。 (1)①Y是镁元素,根据1~18号元素原子最外层电子数与原子序数的关系...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:流程题
高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:
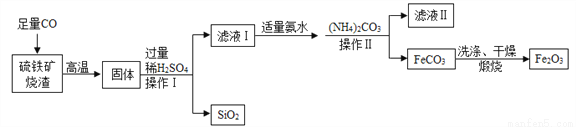
已知:(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解。
(1)高温时硫铁矿烧渣中的Fe2O3与CO发生反应的化学方程式为______________________________。
(2)实验室中,步骤1、步骤Ⅱ中实现固液分离的操作为________,用到的玻璃仪器有玻璃棒、烧杯、_____等。
(3)步骤Ⅱ中由(NH4)2CO3生成FeCO3的变化属于______________(填基本反应类型),加适量氨水的目的是___________________________________。
(4)洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志是“取最后一次洗涤液,加入适量的________溶液,无白色沉淀产生”。
(5)加入(NH4)2CO3后,该反应必须控制的条件是____________________。
Fe2O3 + 3CO2Fe + 3CO2 过滤 漏斗 复分解反应 中和过量的硫酸 BaCl2 温度控制在40℃以下 【解析】本题考查的是常见的物质制备和分离的知识,依据已有的知识进行分析,熟练掌握有关物质的化学性质是解题的关键。 (1)高温时Fe2O3与CO反应生成铁和二氧化碳,化学方程式为Fe2O3 + 3CO2Fe + 3CO2; (2) 过滤是把不溶于液体的固体物质跟液体...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:简答题
要实现“化学让生活更美好”,必须保护环境,但导绿色生活。试回答下列问题:
(1)如皋有文化遗产“元宵花灯”和“提线木偶”等等。元宵花灯采用塑料亚克力(PMMA)制作,具有经久耐用的特点,PMMA属于_________(填“金属”或“合成”)材料;提线木偶装饰材料有蚕丝和棉花等,鉴别蛋丝和棉花的方法是__________________________________。
(2)氢气是一种无污染的燃料,研究发现:利用硫-----碘循环可分解水制氢气。其中主要涉及下列反应(反应条件已略):Ⅰ、SO2+2H2O+I2=H2SO4+2HI;Ⅱ、2HI=H2↑+I2,Ⅲ、2H2SO4=2SO2↑+O2↑+2H2O
请回答:循环分解水的过程中产生O2和H2的质量比为____________。
(3)酸雨也是环境问题之一。
①酸雨的pH值________(填“>”、“<”或者“=”)5.6
②若A是造成酸雨的主要物质。工业生产硫酸过程中通过下列反应得到A:4FeS2+11O2=2Fe2O3+8A在空气中,A发生以下系列转化,最终形成酸雨:转化“A→B"的化学方程式为__________。
(4)如图是利用缺铁性氧化物〔Fe(1-y)O〕进行CO2再资源化研究的示意图。
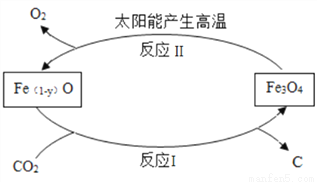
①反应Ⅰ______(填“提高”或降低”)了铁的氧化物中铁的质量分数。
②上图所示两个转化过程均属于_______(填“物理”或“化学”)变化,如该研究成熟并广泛应用,能改善的环境问题是_____________。
合成 灼烧,闻气味 8:1 < 2SO2+O22SO3 降低 化学 温室效应 【解析】本题主要考查了常见材料的识别和检验,质量守恒定律的运用,元素质量分数的计算等 (1) PMMA是一种塑料,塑料属于有机合成材料,蚕丝的主要成分是蛋白质,灼烧时能产生烧焦羽毛的气味;棉花的主要成分是纤维素,灼烧时不能产生烧焦羽毛的气味,鉴别蛋丝和棉花的方法是灼烧,闻气味; (2)由循环分解水的反应...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:综合题
实验探究和证据推理是提升认知的重要手段,化学兴趣小组对"CO2与NaOH溶液反应”的实验进行探究。
Ⅰ探究CO2的制备
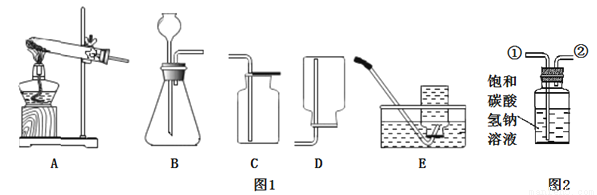
(1)实验室通常利用上图1中__(填字母)装置的组合制取并收集二氧化碳,反应的化学方程式为________
(2)图2所示装置可用于除去二氧化碳中少量的氯化氢气体,除杂时应将混合气体从导管____(填“①”或“②”)通入装置中。
Ⅱ探究CO2与NaOH溶液能否反应
实验甲:向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡后放在水平的桌面上(如图3)。
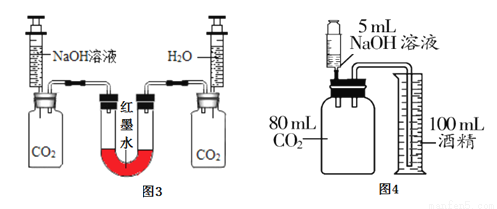
(1)若观察到U型左端液面_______(填“升高”成“降低”),则证明氢氧化钠能与二氧化碳反应。
(2)对静置后左瓶内的溶液进行下列操作,由对应的现象可推知CO2与NaOH一定反应的是_____(填对应选项的字母)。
a.滴加酚酞,溶液变为红色 b.滴加少量稀盐酸,不产生气泡 C,滴加少量氯化钙溶液,产生白色沉淀
实验乙:在NaOH固体中加入适量95%的乙醇溶液,配制成饱和NaOH的乙醇溶液,向该溶液中通入CO2,直至产生白色沉淀Na2CO3,证明氢氧化钠能与二氧化碳反应。
(3)该实验利用的原理是:___________影响物质的溶解性。
实验丙:如图4所示,将5mL溶质质量分数为10%的NaOH溶液(ρ≈1.1gmL)缓慢、全部注射入瓶中,观察到酒精倒流入瓶中,最终瓶中剩余5mL气体。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精。
(4)实验时_____________(填“能”或“不能”)用水代替量筒中的酒精。
(5)实验时将NaOH溶液缓慢注射入瓶中的原因是____________________。
(6)根据上述实验可推知:与NaOH反应的CO2约为________________(取整数)mL
BC CaCO3 +2HCl==CaCl2 + H2O +CO2↑ ① 升高 C 溶剂 不能 防止CO2气体从导管逸出 70 【解析】本题主要考查了二氧化碳的制取,碱、盐的化学性质,物质的溶解性的影响因素等,综合性较强,仔细审题,弄清题意,灵活运用所学的知识。 Ⅰ探究CO2的制备 (1)实验室制取CO2,在常温下,用大理石或石灰石和稀盐酸制取,属于固—液常温型;二氧化碳能溶于水,...查看答案和解析>>
科目: 来源:江苏省南通市如皋市2018届九年级一模化学试卷 题型:综合题
某品牌可乐汽水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等按一定比例混合并压入二氧化碳配制而成。
(1)磷酸中H、P、O三种元素的质量比为_______________。
(2)某同学为了定量测定可乐中磷酸的含量,进行如下实验
步骤1:取可乐样品25mL,加入活性炭,浸泡、过滤、洗涤。
步骤2:将滤液煮沸10min,冷却,加入适量蒸馏水。
步骤3:继续往滤液中加几滴某指示剂,再逐滴滴入0.1%的NaOH溶液20g,恰好完全反应。(测定原理: H3PO4+NaOH=NaH2PO4+H2O)
①步骤1中活性炭的作用是_____________________
②步骤2中“煮沸10min"能除尽滤液中CO2的原因之一是当温度升高时,气体的溶解度_______(填“变大”“变小”或“不变”)。
③计算1L可乐中磷酸的含量_____________。
3:31:64 吸附色素 变小 1.96g/L 【解析】本题考查了根据化学式、化学方程式的计算。 (1)磷酸中H、P、O三种元素的质量比=(1×3):(1×31):(16×4)= 3:31:64; (2) ①活性炭具有疏松多孔的结构,有吸附性,可以吸附色素和异味。步骤1中活性炭的作用是吸附色素; ②当温度升高时,气体的溶解度变小; ③20g 0.1%的NaOH溶液中的...查看答案和解析>>
科目: 来源:广东省深圳市耀华实验学校2017-2018学年八年级下学期期中考试化学试卷 题型:单选题
下列变化遵循质量守恒定律的是
A. 石墨制成金刚石 B. 5g食盐溶解在95g水中,形成了100g食盐水溶液
C. 液氧变成固态氧 D. 冰转化成干冰
A 【解析】质量守恒定律是指化学反应中遵循的质量关系。 化学变化的实质是反应物的分子分成原子,原子再重新组合成新的分子,化学变化前后,原子的种类,个数、质量不变,故所有的化学变化都遵循质量守恒定律。A. 石墨制成金刚石,是化学变化,故遵循质量守恒定律; B. 5g食盐溶解在95g水中,形成了100g食盐水溶液,是物理变化,不遵循质量守恒定律;C. 液氧变成固态氧,是物理变化,不遵循质量守恒定...查看答案和解析>>
科目: 来源:广东省深圳市耀华实验学校2017-2018学年八年级下学期期中考试化学试卷 题型:单选题
双氧水分解成水和氧气的反应前后,发生改变的是
A. 分子种类 B. 原子种类 C. 元素种类 D. 原子数量
A 【解析】化学变化的实质是反应物的分子分成原子,原子再重新组合成新的分子,化学变化前后,原子的种类,个数、质量不变。即化学变化前后分子的种类改变,原子的种类不变。双氧水分解成水和氧气的反应前后,发生改变的是分子的种类。故选A。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com