
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:填空题
用化学用语填空。
(1)2个氢原子_____________;
(2)氖气_____________;
(3)4个亚铁离子_____________;
(4)N2O5中氮元素的化合价_____________。
2H Ne 4Fe2+ 【解析】本题主要考查了化学用语的书写和理解能力。 (1)原子的表示方法是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。所以2个氢原子可表示为:2H; (2)氖是稀有气体元素,由稀有气体元素组成的单质是单原子分子,所以氖气的化学式就是表示氖元素的元素符号,即:Ne; (3)离子的表示方法是在表示该离子的元素符号右上角,标出该...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:简答题
如图所示的实验能验证水的组成:
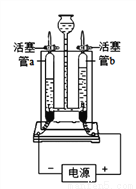
(1)接通直流电源一段时间后,玻璃管b内产生的气体是_________,该管内产生约4g气体时,玻璃管a内产生约_______g气体。
(2)上述实验说明水是由_____________组成的。
(3)该实验中,往电解器玻璃管里加满含有酚酞的硫酸钠溶液(硫酸钠只增强导电性,不发生反应)。在实验过程中,观察到管b电极附近的溶液迅速变红,则该处溶液呈___________(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7,说明电解时管a电极附近的溶液呈________(填“酸”“碱”或“中”)性。
(4)该实验中,若水中加入少量硫酸以增强导电性,硫酸不发生反应,则电解后溶液的pH_________(填“增大”“减小”或“不变”)。
氧气 0.5 氢元素和氧元素 碱 酸 减小 【解析】本题考查了电解水实验,溶液的酸碱性与pH值的关系。 (1)玻璃管b连接电源的正极,产生的气体体积较小,产生的是氧气;则玻璃管a中产生的是氢气,由化学方程式2H2O 2H2↑+O2↑可知,生成氢气与氧气的质量比为4:32=1:8,若b管内产生约4g氧气时,玻璃管a内产生约0.5g氢气; (2)电解水生成氢气与氧气,由质量守恒定律可...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:简答题
归纳总结是学习化学的重要方法,小明同学用图一总结了盐酸的四条化学性质(即盐酸与四类物质能够发生化学反应)。
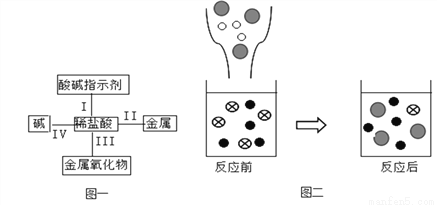
(1)验证性质I,小明将石蕊溶液滴入稀盐酸中,现象是________________。
(2)验证性质II,能与稀盐酸反应的物质是______________(填序号)。
A.Mg B.Fe2O3 C.Al D.Au
(3)验证性质IV,小明往氢氧化钾溶液中滴加稀盐酸。
①该反应的化学方程式是_____________________;
②图二表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):  _____________,
_____________, ______________;
______________;
③从图二中可以看出,反应后的溶液pH______7(填 “>”、“<”或“=”)。
溶液变红色 A C KOH + HCl=KCl +H2O K+ Cl- > 【解析】本题考查了酸的化学性质,溶液的酸碱性与pH值的关系,中和反应的实质,化学方程式的书写等。 (1)石蕊溶液试液遇酸性溶液呈红色,验证性质I时,小明将石蕊溶液滴入稀盐酸中时,稀盐酸显酸性,能使石蕊溶液变红色; (2)性质II是酸与金属的反应。验证性质II时,能与稀盐酸反应的金属单质是镁、铝,稀盐酸和镁...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:简答题
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
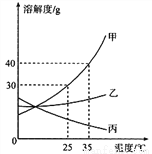
(1)25℃时,将2g甲固体加入到5g水中,充分溶解并恢复到原温度后,得到溶液的质量为__________g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是_________。
(3)现有操作步骤:A.溶解B.过滤C.降温结晶D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是___________。(填字母序号)
(4)若将35℃时甲的饱和溶液降温到25℃,则其溶液的溶质质量分数会__________。(填“变大”“变小”或“不变”)
6.5 加入一定量固体丙 ADCB 变小 【解析】本题考查了溶解度曲线及其应用,有关溶液的计算和溶质质量分数的变化。 (1)25℃时,甲的溶解度是30g,25℃时,100 g水中最多溶解30g甲,将2g甲固体加入到5g水中,最多溶解的甲的质量=g=1.5g,充分溶解并恢复到原温度后,得到溶液的质量=1.5g+5g=6.5g; (2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:流程题
以钛铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3 、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:
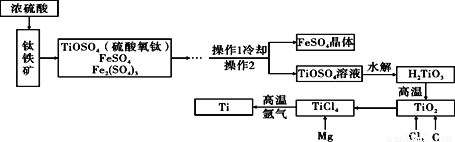
(1)写出由TiCl4制得Ti的化学反应方程式(已知该反应为置换反应): ___________。
(2)由H2TiO3制得TiO2的反应与碳酸分解类似,写出该反应方程式: ___________。
(3)工艺流程中,水解属于_________变化。(填“物理”或“化学”)
(4)操作2的名称是________________。
(5)TiO2可与焦炭、氯气在高温下反应,该反应为TiO2+2C+2Cl2==TiCl4+2X,则物质X的化学式为__________。
2Mg + TiCl4 2MgCl2 + Ti H2TiO3 H2O +TiO2 化学 过滤 CO 【解析】本题考查了化学变化和物理变化的判别,质量守恒定律及其应用,化学方程式的书写等。 (1)四氯化钛和镁在高温的条件下发生置换反应,生成钛和氯化镁,化学方程式为:2Mg + TiCl4 2MgCl2 + Ti; (2)钛酸分解生成二氧化钛和水,化学方程式为:H2TiO3 H2O ...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:科学探究题
某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】A.可能与硫酸的质量分数有关;B.可能与锌的颗粒大小有关。
【设计并实验】用不同质量分数的硫酸和不同颗粒大小的锌进行如下实验:
实验编号 | 硫酸的质量分数 (均取200ml) | 锌的颗粒大小 (均取1g) | 氢气的体积/ml (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌粉 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌粉 | 丢失 |
【收集证据】要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是_________。
【得出结论】完成①③三组实验后得出的结论是:_____________。
【评价与反思】(1)下表是第①组实验的详细数据。
时段 | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
氢气的体积 | 3.1ml | 16.7ml | 11.9ml | 9.6ml | 7.6ml | 6ml |
上述表格可知,从第3分钟开始反应的速率减慢,其原因是_____________。
(2)由于没有及时记录数据,导致第④组实验数据丢失,经同学组回忆,得到以下数据,你认为可能的是____________(填序号)。
A.45.7 B.54.7 C.75.4
①③ 在其他条件相同时,硫酸的浓度越大,反应速率越快 随着反应进行,硫酸的浓度减小,化学反应的速率相应减弱 C 【解析】本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,注意控制变量的运用。 收集证据:要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,观察产生氢气的快慢,因此可以选择①③...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:简答题
实验室有如右图所示装置,回答下列问题:
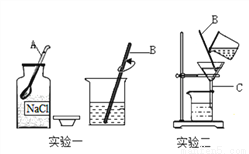
(1)填写仪器的名称:A_________;C___________。
(2)仪器B在实验一、实验二中的作用分别是____________;_________。
药匙 漏斗 搅拌,加速NaCl固体的溶解 引流,防止滤液将滤纸击穿,避免滤液飞溅 【解析】本题考查了过滤,物质的溶解。熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解题的关键。 (1)仪器A是药匙;仪器C是漏斗。 (2)实验一、实验二分别为溶解、过滤操作,仪器B是玻璃棒,作用分别是搅拌、加速NaCl固体的溶解,引流。查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:实验题
根据下列装置图,回答问题:

(1)用高锰酸钾制取氧气,选用的发生装置是_____(填序号),为防止高锰酸钾粉末进入导管,该装置需做一点改进的是_________,若用D装置收集氧气,当观察到_________时,便可开始收集。
(2)实验室制取二氧化碳应选用的一组装置是____________________(填序号),反应的化学方程式是_____________。图G是某同学利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:______________。
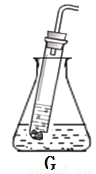
(3)用收集的氧气完成图E铁丝燃烧的实验,集气瓶中预先放少量水的原因是________;如图F向装满CO2软塑料瓶注入约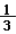 体积的水,立即旋紧瓶塞,振荡。观察到的现象是________________。
体积的水,立即旋紧瓶塞,振荡。观察到的现象是________________。
查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:科学探究题
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究:
【提出问题】假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;假设3:红色粉末是铜粉和氧化铁粉。
【设计实验方案】同学们对实验作了如下设想和分析:取5g红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如下图)。
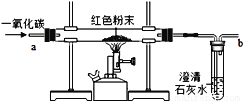
【进行实验】通过实验及分析。若确认假设3成立,则硬质玻璃管中出现的现象是____________。
【反思与评价】(1)实验过程中,硬质玻璃管内发生的化学反应方程式是_________;
(2)实验时通入一氧化碳片刻后再加热的原因是______;
(3)从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是________;
(4)若得到铁的质量为2.24g,则原来混合物中氧化铁粉末的质量分数为_____________。
【知识拓展】实验结束后得到了铜和铁,现为了进一步探究铁和铜的金属活动性强弱,还需要选择的试剂______________(填序号)。
A.碳酸钠溶液 B.稀盐酸 C.氯化锌溶液 D.硝酸铜溶液
红色粉末部分变黑色 Fe2O3 + 3CO 2Fe + 3CO2 排出管内的空气,避免CO与空气混合受热发生爆炸 在b处放一盏点燃的酒精灯 64% B 或 D 【解析】本题考查了一氧化碳还原氧化铁的实验,金属活动性顺序的探究等。解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。 进行实验: 若确认假设3成立,则硬质玻璃管中,高温条件下氧化铁和一氧化碳反...查看答案和解析>>
科目: 来源:广东省广州市2018届中考一模化学试卷 题型:科学探究题
某兴趣小组在准备化学实验基本技能考试时,对以下问题进行了探究。
I.探究酸和碱能否发生化学反应
(1)方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由________色变成无色。甲同学得出结论:酸和碱能发生反应。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
(2)交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须________7(填“大于”、“小于”或“等于”),才能证明酸和碱能发生反应。
II.探究酸和碱反应后溶液中溶质的成分
丙同学对探究I中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【提出猜想】猜想(l):Na2SO4;猜想(2):Na2SO4和____________。
【设计实验】现实验室提供以下试剂:锌粒、铜片、氯化钡溶液、氢氧化钠溶液以及必要的实验仪器,请完成下列表格:
实验操作 | 实验现象 | 实验结论 |
_____________ | _________ | 猜想(2)成立 |
【实验结论】猜想(2)成立
红 等于或小于 H2SO4 取适量甲同学实验反应后的溶液于试管中,加入锌粒,观察现象 锌粒溶解,并有气泡产生 【解析】本题考查了中和反应,酸、碱的化学性质。 Ⅰ、方案l:氢氧化钠溶液显碱性,滴入无色酚酞试液变红色,继续加入稀硫酸,硫酸与氢氧化钠发生中和反应生成硫酸钠和水,当加入的硫酸将氢氧化钠完全中和后,溶液变成无色,得出结论:酸和碱能发生反应; 方案2:溶液pH减小的原因还可能...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com