
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:填空题
据央视2017年5月18日报道,我国在南海神狐海域从海底以下可燃冰矿藏中成功开采出天然气,为全球首例,对缓解我国的能源危机具有非常重要的作用。
(1)天然气的主要成分甲烷在空气中充分燃烧的化学方程式是___________________;
(2)开采可燃冰矿藏采过程中若大量气体泄漏,会比二氧化碳造成的_______更严重。
CH4 + 2O2 CO2 + 2H2O 温室效应 【解析】(1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;(2)根据温室效应的成因和可燃冰的成分进行分析。(1)甲烷燃烧生成了二氧化碳和水,反应的方程式是CH4+2O2点燃2H2O+CO2。(2)可燃冰具有能量高、燃烧值大等优点。但它的主要成分甲烷是一种温室气体,如果开采不当,甲烷气体将大量泄漏...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:简答题
在一个密闭容器中放入M、N、P、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,请据表完成以下内容:
物质 | M | N | P | Q |
反应前质量/g | 20 | 2 | 1 | 37 |
反应后质量/g | X | 32 | 1 | 12 |
(1)物质P在该反应中的作用或角色______________________;
(2)表中的X的值为__________;
(3)该反应的基本反应类型为__________________;
(4)反应中N、Q的质量比为________________(化简到最简整数比)。
催化剂或杂质或不参加反应的物质 15 化合反应 6︰5 【解析】根据表中数据分析并结合质量守恒定律计算解答。(1)物质P在反应前后质量不变,故物质P在该反应中的作用或角色是催化剂或杂质或不参加反应的物质;(2)表中的X的值=20+2+1+37-12-1-32=15;(3)根据反应前后物质的质量变化可得,M反应后质量减少为反应物;N反应后质量增加,为生成物;Q反应后质量减少,为反应物。该反应符...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:简答题
(题文)相同质量的M、N两种金属,分别与足量的同种稀盐酸反应(M、N在生成物中均为+ 2价),生成氢气质量和反应时间的关系如图所示: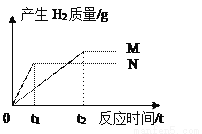
(1)相对原子质量:M_____N(填“>”、“=”、或“<”);
(2)金属活动性:M_____N(填“>”、“=”、或“<”);
(3)消耗盐酸的质量:M_____N(填“>”、“=”、或“<”);
(4)若M为铁,请写出它与盐酸反应的化学方程式_____________。
< < > Fe + 2HCl = FeCl2 + H2↑ 【解析】产生氢气的快慢与金属活动性有关,金属活动性越强生成的氢气的速率越快;生成氢气的多少与金属的相对原子质量有关,相对原子质量小的生成的氢气多。(1)相对原子质量:M<N;(2)金属活动性:M<N;(3)消耗盐酸的质量:M>N;(4)若M为铁,铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe + 2HCl = FeCl2 +...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:简答题
化学就在身边,请利用所学化学知识回答下列问题。
(1)妈妈买了一件羊毛上衣,小芳怀疑衣服面料成分是合成纤维,她采用的鉴别方法是_______;
(2)妈妈为小芳准备了米饭、红烧肉、高钙牛奶,请你从营养均衡的角度考虑,还应补充的营养素________(填序号); A.糖类 B.蛋白质 C.油脂 D.维生素
(3)小芳发现铝制门窗比较耐腐蚀,主要原因是____________(用化学方程式表示);
(4)小芳还发现新买的家具带有异味,于是在室内放了几个活性炭包,达到除去异味的目的,这是利用了活性炭的____________性;
(5)吃完饭后小芳用洗洁精去除餐具表面的油污,是利用了洗洁精的__________作用。
燃烧(闻气味) D 4Al + 3O2 = 2Al2O3 吸附 乳化 【解析】(1)羊毛的主要成分是蛋白质,蛋白质燃烧时能产生烧焦羽毛的气味;(2)根据人体所需六大营养素的种类、食物来源和合理膳食的原则,结合题中所给的食谱判断所含的营养素以及缺少的营养素,进行分析解答;(3)根据金属的化学性质进行分析解答;(4)根据活性炭具有吸附性进行分析解答;(5)根据洗洁精具有乳化作用分析解答。(1)羊...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:推断题
请分析如图盐的化学性质知识网络,完成下列问题:
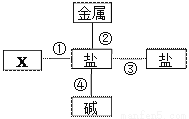
(1)图中的X填写___________(填物质的类别);
(2)若金属为铜,盐为硝酸银,请写出反应②的化学方程式_______________;
(3)请根据下表所提供的部分物质的溶解性表,写出符合反应④的化学方程式__________。
OH- | NO3- | SO42- | |
Na+ | 溶 | 溶 | 溶 |
Cu2+ | 不 | 溶 | 溶 |
查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:推断题
A、B、C、D、E、F、G是初中化学常见的物质,A是铁锈的主要成分,B、D组成元素相同,E是密度最小的气体。根据图中相互转化关系完成下列问题(部分反应物、生成物、反应条件已略去)。

(1)G的化学式是___________;
(2)写出有关反应的化学方程式:①______________; ②___________。
H2CO3 Fe2O3 + 3CO 2Fe + 3CO2 2H2 + O2 2H2O 【解析】根据A是铁锈的主要成分,能够和B反应产生C和D,B、D组成元素相同,因此A是氧化铁,B是一氧化碳,C是铁,D是二氧化碳;铁反应产生E,E是最轻的气体,因此E是铁与酸反应产生的氢气;氢气点燃产生F,F是水;水和二氧化碳反应产生的G应该是碳酸,带入验证完成相关的问题。A是赤铁矿的主要成分,能够和B反应产...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:实验题
某同学欲配制一定溶质质量分数的NaCl溶液,他准备了下列实验仪器。
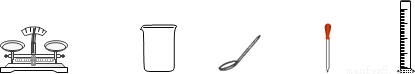
(1)称量时,NaCl固体粉末应放在托盘天平____(填“左盘”或“右盘”)的纸片上;
(2)配制过程中为促进NaCl的溶解,还需要的一种玻璃仪器是___(填仪器名称);
(3)量取一定体积的水,除了用量筒外,还需要用______(填仪器名称);
(4)若该同学在量筒读数时,采用了俯视的方法,其它操作均正确,则最后所配制的NaCl溶液溶质的质量分数将____________(填“变大”、“变小”或“不变”)。
左盘 玻璃棒 (胶头)滴管 变大 【解析】(1)根据称量时,药瓶不能直接放在托盘上,且左物右码解答;(2)根据配制溶液时所用的仪器解答;(3)根据用量筒量取一定的体积液体时,应选择合适的量筒;向量筒内加液时,先用倾倒法加液到近刻度线,再改用胶头滴管加液到刻度线解答;(4)根据读数时“仰小俯大”分析解答。(1)称量时,药品不能直接放在托盘上,可放在称量纸上,且左物右码,故填:左盘;(2)配制过...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:科学探究题
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。
(演示实验)将一定量稀盐酸加入到盛氢氧化钠溶液的小烧杯中。该反应的化学方程式为_________。
(查阅资料)NaCl 溶液显中性
(提出问题)反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想一:NaCl
猜想二:NaCl和HCl
请你写出一种可能的猜想:_______________
(实验探究)为了验证猜想,实验小组分组分别进行了以下三个方案的探究。
实验操作 | 实验现象 | 实验结论 |
(1)滴加紫色石蕊溶液 | __________________ | 溶液中含有HCl |
(2)加入少量CuO粉末 | 粉末溶解,溶液变蓝 | 溶液中含有HCl |
(3)滴加Na2CO3溶液 | __________________ | 溶液中含有HCl |
请写出实验操作(2)中反应的化学方程式_____________________________________。
(得出结论)通过探究,猜想二是正确的。
(评价反思)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑________。
HCl + NaOH = NaCl + H2O NaCl和NaOH (紫色)石蕊溶液变红 产生气泡或有无色无味的气体产生 CuO + 2HCl = CuCl2 + H2O 反应物是否过量或有剩余 【解析】【演示实验】根据盐酸与氢氧化钠反应生成氯化钠和水解答;【猜想与假设】根据氢氧化钠可能过量分析解答;【实验探究】(1)根据紫色石蕊溶液遇酸变红解答;(3)根据碳酸钠溶液与盐酸反应有二氧化碳气体...查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:计算题
葡萄糖(C6H12O6)是自然界分布最广且最为重要的一种单糖,它在糖果制造业和医药领域有着广泛应用。
(1)葡萄糖中氧元素和碳元素的质量比是____________(化简到最简整数比);
(2)要将100g溶质质量分数为10%的葡萄糖溶液配制成20%,可加_______g葡萄糖。
4︰3 12.5 【解析】(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据溶质质量分数的概念计算解答。(1)葡萄糖中氧、碳元素的质量比为(16×6):(12×6)=4:3;(2)设可加葡萄糖的质量为x。20%,x=12.5g。查看答案和解析>>
科目: 来源:山东省临沂市罗庄区2018届九年级期中学业水平调研测试化学试卷 题型:计算题
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。某化学课外兴趣小组的同学决定测定该瓶氢氧化钠变质的程度。
(1)请写出氢氧化钠在空气中变质的化学方程式_______________;
(2)测定步骤
第一步:取该瓶中的氢氧化钠固体样品10g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称重,生成沉淀为1g。
请计算该10g氢氧化钠固体中含有杂质Na2CO3的质量分数_________。
2NaOH + CO2 = Na2CO3 + H2O 10.6%。 【解析】(1)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水;(2)由生成沉淀碳酸钙的质量计算样品中碳酸钠的质量,该质量与样品的质量比可计算含有杂质Na2CO3的质量分数。(1)氢氧化钠在空气中变质的化学方程式为2NaOH+CO2=Na2CO3+H2O;(2)设碳酸钠的质量为x。 Na2CO3+Ca(OH)2═CaCO3↓...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com