
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:填空题
高纯铊(Tl)及其合金可做半导体材料。已知硫酸亚铊(T12SO4)溶液为无色,氢氧化亚铊(T1OH)溶液显黄色;用硫酸亚铊溶液可制得氢氧化亚铊,氢氧化亚铊加热分解生成氧化亚铊(T12O)和水,氧化亚铊与氢气加热得到铊。
(1)铊元素的化合价有+1、+3价,写出氧化铊的化学式_________________。
(2)取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡、静置,观察到的实验现象是_________,反应的化学方程式为________________。
(3)氢氧化亚铊加热分解的化学方程式为________________。
(4)氧化亚铊与氢气加热生成铊和水,该反应属属于______________(填反应类型)。
Tl2O3 有白色沉淀生成,溶液由无色变成黄色 Tl2SO4 + Ba(OH)2 == BaSO4↓ + 2TlOH 2TlOH Tl2O + H2O 置换反应 【解析】(1)氧化铊中铊元素的化合价为+3,所以化学式为Tl2O3; (2)硫酸亚铊能与氢氧化钡反应生成硫酸钡沉淀和氢氧化亚铊,化学方程式为:Tl2SO4+Ba(OH)2═BaSO4↓+2TlOH;故会观察到有白色沉淀生成,溶...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:填空题
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
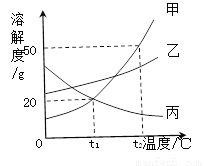
(1)气体的溶解度随温度变化的情况与________(填“甲”、“乙”或“丙”)相似。
(2) t2℃时,将65g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为________g。
(3)要使t2℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是___________。
(4)若将t2℃时甲的饱和溶液降温到t1℃,则其溶液的溶质质量分数会_________(填“变大”、“变小”或“不变”)。
丙 150 加入丙物质,或蒸发溶剂(或加热蒸发溶剂后恢复到t2℃) 变小 【解析】(1)气体的溶解度随温度的升高而减小,所以变化的情况与丙相似; (2)t2℃时,甲物质的溶解度是50g,所以将65g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为150g; (3)要使t2℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是蒸发溶剂; (4)若将...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:综合题
碳酸钡广泛用于陶瓷、光学玻璃等行业。有一种碳酸盐矿石,其主要成分是碳酸钡和碳酸钙,现以此矿石为原料生产碳酸钡,并得到副产品氢氧化钙,其流程如下图所示:
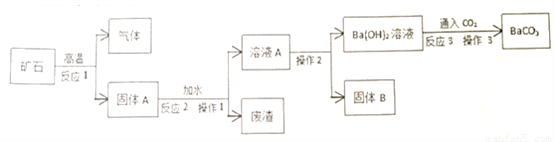
已知,氢氧化钡和氢氧化钙在不同温度下的溶解度是:
温度/℃ | 0 | 40 | 80 |
氢氧化钡溶解度/g | 1.67 | 8.22 | 101.4 |
氢氧化钙溶解度/g | 0.187 | 0.141 | 0.094 |
请回答
(1)碳酸钡与碳酸钙的化学性质相似,高温下能分解成两种氧化物,碳酸钡在高温下分解的化学方程式为______________。
(2)氧化钡与氧化钙的化学性质相似,能与水反应。溶液A中存在的阳离子是___________(写离子符号)。
(3)在实验室里完成操作1,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(4)操作2采用的操作方法依次为____________(填序号)。
A.过滤 B.降温 C.加热 D.蒸馏 E.灼烧
(5)反应3的化学方程式为___________________________________________。
(6)废渣要经过洗涤后才能弃渣,原因是________________________。
(7)假设该碳酸盐矿石中含有40%的碳酸钙,那么50kg该矿石理论上可制得氢氧化钙的质量是________kg。
BaCO3 = BaO + CO2↑ Ba2+、Ca2+ 烧杯 C A Ba(OH)2 + CO2 == BaCO3↓ + H2O 充分利用原料,保护环境 14.8 【解析】(1)碳酸钡与碳酸钙的化学性质相似,高温下能分解成氧化钡和二氧化碳,化学方程式为BaCO3 BaO + CO2↑; (2)氧化钡与氧化钙的化学性质相似,能与水反应分别生成氢氧化钡和氢氧化钙。溶液A中存在的阳离子是B...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:填空题
在盛有少量稀盐酸的烧杯中加入足量的碳酸镁固体至恰好完全反应。请回答:
(1)上述反应中的实验现象为___________________________。
(2)下图表示加入碳酸镁固体前后溶液中存在的主要离子,写出每种图形代表的离子
(写离子符号)。
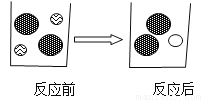
 __________,
__________, __________,
__________,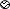 ____________。
____________。
(3)下列物质中能与盐酸反应,而且反应前后溶液中的离子种类和个数比变化与上图相似的是_________________(填序号)。
A.CuO粉末 B.KOH溶液 C. BaCO3固体 D.Cu片
固体逐渐溶解,有气泡产生 Cl- Mg2+ H + AC 【解析】(1)碳酸镁和盐酸反应生成氯化镁、水和二氧化碳,所以反应中的实验现象为固体逐渐溶解,有气泡产生; (2)碳酸镁和盐酸反应生成氯化镁、水和二氧化碳,加入碳酸镁固体前,溶液中含有大量的氢离子、氯离子,加入后,溶液中含有大量的镁离子、氯离子;所以表示氯离子,表示镁离子,表示氢离子; (3)A、氧化铜与盐酸反应生成氯化铜和...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:实验题
请根据下列实验装置回答问题:
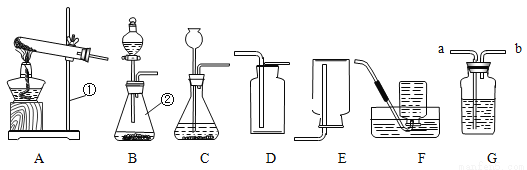
(1)写出仪器①②的名称:①__________________;②_____________________。
(2)用高锰酸钾制取氧气的化学方程式为________________________________;当用F装置收集满O2并取出集气瓶后,停止该实验的正确操作方法是________________。
(3)可用E装置收集的气体是________________(需答两种)。
(4)硫化氢(H2S)是有毒气体,实验室常用块状硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢(H2S)气体,应选用的发生装置最好是_________________。
(5)检査C装置气密性的方法是:先用弹簧夹夹住导气管上的胶皮管,再向长颈漏斗中 加入水_______________________,静置,若观察到________________,说明气密性良好。
(6)G装置可用于气体的收集、检验、除杂和体积的测量等,用该装置不能完成的实验是______________(填序号)。
A.气体从a端通入,收集氢气。
B.瓶内装有澄清石灰水,气体从a端通入,检验氧气中中是否混有二氧化碳。
C.在b端连接量筒,瓶内装满水,氧气从a端通入,测量气体的体积。
D.瓶内装有氢氧化钠溶液,气体从a端通入,吸收一氧化碳中混有的二氧化碳。
铁架台 锥形瓶 2KMnO4 K2MnO4 + MnO2 + O2↑ 先把导管移出水面,再熄灭酒精灯 H2、CH4 B 直至长颈漏斗下端形成一段水柱 水柱液面不下降 AC 【解析】(1)仪器①为铁架台,仪器②为锥形瓶, (2)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4 K2MnO4 + MnO2 + O2↑;当用装置F收集满并取出集气瓶后,为防止水槽里...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:科学探究题
为探究影响氯酸钾分解速率的因素,小红同学把实验温度恒定在330℃或380℃,(其他实验条件见下表),并设计了以下实验。
实验编号 | 氯酸钾的质量 | 其他物质的质量∕g | 温度∕℃ | 收集氧气的体积/mL | 反应所需时间∕s |
① | 2.0 | 330 | 100 | t1 | |
② | 2.0 | CuO 0.5 | 330 | 100 | t2 |
③ | 2.0 | MnO2 0.5 | 330 | 100 | t3 |
④ | 2.0 | MnO2 ____ | _______ | 100 | t4 |
请回答
(1)进行实验②和③,并对对比,其实验目的是____________________。
(2)要说明氧化铜对氯酸钾分解速率的影响,则要选用实验______和实验_______进行对比。
(3)用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是__________g,反应的温度是_________℃,实验④发生反应的化学方程式为___________________;若t3>t4,氯酸钾分解速率与温度的关系是__________________。
相同条件下,探究CuO和MnO2对氯酸钾分解速率的影响 ① ② 0.5 380 2KClO3 2KCl + 3O2↑ 在相同的条件下,温度越高,氯酸钾分解速率越快 【解析】(1)实验②和③的变量是催化剂种类,进行对比,其实验目的是相同条件下,探究CuO和MnO2对氯酸钾分解速率的影响; (2)要说明氧化铜对氯酸钾分解速率的影响,所以变量为氧化铜的有无,则要选用实验①和实验②进行对比; ...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:实验题
化学实验中经常用到一定溶质质量分数的溶液。
(1)实验室配制质量分数为4%的氯化钠溶液50g
①需要固体氯化钠的质量_____________g,水___________mL(水的密度1g∕cm3)
②用托盘天平称量所需的氯化钠钠时,移动好游码,向托盘中加入氯化钠,若指针偏向分度盘的左边,要进行的操作是_____________________。
(2)若用质量分数为6%的氯化钠溶液液(密密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液。
①需要6%的氯化钠溶液_________mL(计算结果保留一位小数),水________g。
②该溶液配制过程中除用到量筒、玻璃棒和烧杯外,还需要的仪器是_____________。
2 48 用药匙从托盘中取出少量氯化钠 24.0 25 滴管 【解析】(1)①实验室配制质量分数4%的氯化钠溶液50g,需要固体氯化钠的质量为50g×4%=2g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-2g=48g;水的密度为1g/cm3,则体积为:48mL; ②放好砝码和游码后,向托盘中加入氯化钠时,若指针偏向分度盘的左边,说明左盘中氯化钠的质量偏大,所以要需要用药匙取...查看答案和解析>>
科目: 来源:广东省广州市海珠区2018年九年级中考一模化学试卷 题型:科学探究题
为证明某化肥硝酸铵样品中含有氯化铵、硫酸钾,小明同学进行了以下实验,请你参与探究。
(1)取少量硝酸铵样品于烧杯中,加水溶解,溶液中的阳离子有___________(写离子符号)。
(2)请你设计实验证明硝酸铵样品中确实含有氯化铵、硫酸钾。
实验操作 | 预期现象与结论 |
取少量(1)中溶液于试管中,___________。 | __________________ |
________________ | ______________________ |
查看答案和解析>>
科目: 来源:江苏省连云港市2018届九年级下学期全真模拟(五)化学试卷 题型:单选题
下列一些行为和举措,有利于改善空气质量的是
A. 燃放烟花爆竹 B. 大力发展火力发电
C. 露天焚烧垃圾 D. 提高电动汽车的比例
D 【解析】A、燃放烟花爆竹会产生大量的污染空气的二氧化硫等气体和粉尘,不利于改善空气质量,错误;B、火力发电一般为燃煤发电,煤燃烧过程中会产生大量的污染空气的气体和粉尘,不利于改善空气质量,错误;C、焚烧垃圾中会产生大量的污染空气的气体和粉尘,不利于改善空气质量,错误;D、电动汽车的使用可有效的降低汽车尾气排放,改善能源结构,改善空气的质量,利于改善空气质量,正确。故选D。查看答案和解析>>
科目: 来源:江苏省连云港市2018届九年级下学期全真模拟(五)化学试卷 题型:单选题
施肥是农业增产的重要手段。下列属于复合肥料的是
A.Ca3(PO4)2 B.KNO3 C.NH4NO3 D.K2CO3
B 【解析】 试题分析∶A,C,D均只含一种,B.含K,N两种,故B正确。 考点∶考查复合肥料的概念。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com