
科目: 来源:浙江省台州市2018年中考化学试卷 题型:单选题
下列选项所示的物质转化均能一步实现的是
A. Fe Fe2O3
Fe2O3 Fe(OH)3 B. CuO
Fe(OH)3 B. CuO CuSO4
CuSO4 CuCl2
CuCl2
C. S SO2
SO2 H2SO4 D. CO2
H2SO4 D. CO2 Na2CO3
Na2CO3 NaOH
NaOH
查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:单选题
某固体由Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有
A. Na+、CO32-、SO42- B. Cu2+、CO32-、SO42-
C. Cl-、CO32-、SO42- D. Na+、Ba2+、Cl-
A 【解析】含Cu2+的溶液呈蓝色,将固体溶于水得无色透明溶液,说明溶液中无Cu2+,加入足量BaCl2溶液,过滤后得到5克白色沉淀,在沉淀中加入过量稀硝酸,仍有3克白色沉淀,说明固体中含有CO32-、SO42-。因为碳酸钡、硫酸钡是白色沉淀,将固体溶于水得无色透明溶液,所以固体中无Ba2+,固体中无Ba2+、Cu2+,根据溶液呈电中性,则一定含有阳离子Na+。因为加入BaCl2溶液时引入了...查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
图甲是一个“火山爆发”模型。将碳酸氢钠干粉和柠檬酸(C6H8O7)干粉倒入火山模型内,火山模型内没有动静,慢慢注入水,两者就会剧烈反应(3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑),“火山”就会爆发出来。

(1)自然界中的火山是_______变动的表现。
(2)这个模拟实验为什么要加水呢?将碳酸氢钠干粉和柠檬酸干粉混合后,置于试管中(如图乙),立即伸入燃着的木条,火焰没有熄灭。用棉花封住管口,静置约半小时后再伸入燃着的木条,火焰熄灭。可见,水在本模拟实验中的作用是_____。
地壳 使反应在溶液中进行,加快反应速度 【解析】(1)自然界中的火山是地壳变动的表现。(2)本模拟实验加水的目的是使反应在溶液中进行,在溶液中反应物之间接触面积较大,反应物之间接触面积越大,反应速度越快,所以水在本模拟实验中的作用是加快反应速度。查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
草酸固体熔点较低,受热熔化后,迅速分解生成水、一氧化碳和二氧化碳。
(1)草酸(H2C2O4)中,氢、碳、氧原子的个数比为______。
(2)写出草酸受热分解的化学方程式: ______。
(3)加热分解草酸固体,应选择图中的_______装置。
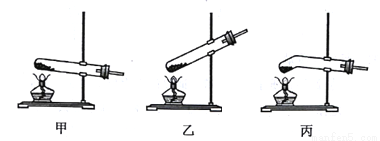
查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
19世纪初,电灯尚未发明,煤矿工人在矿井中只能借助煤油灯照明。矿井中通常存在大量的甲烷气体,遇火极易发生爆炸。1815年,化学家戴维设计出一种安全矿灯——戴维灯(如图)。采用一种网眼很小的普通金属网罩住火焰,火焰只会在网中燃烧而不会引燃外界的甲烷气体。

(1)甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的_______。
(2)用戴维灯照明,不会引燃矿井中的甲烷,原因是_________。
热量 金属网可以把火焰的热量迅速传递出去,矿井中甲烷气体的温度达不到着火点 【解析】(1)甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的热量。(2)用戴维灯照明,不会引燃矿井中的甲烷,原因是金属网可以把火焰的热量迅速传递出去,矿井中甲烷气体的温度达不到着火点。查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
活泼金属能将不活泼金属从其盐的水溶液中置换出来。与此类似,碳在高温下,能将不活泼金属从其氧化物中置换出来,但活泼金属形成的氧化物不与碳发生反应。如碳在高温下,能置换出氧化铁中的铁,但与氧化铝不反应。
(1)判断C、Fe、Al的活动性顺序由强到弱为________。
(2)结合所学知识,下列各组物质能发生置换反应的是_______
A.碳与氧化铜 B.锌与稀硫酸 C.碳与氧化钙 D.银与硫酸铜
Al、C、Fe AB 【解析】(1)碳在高温下,能置换出氧化铁中的铁,则活动性C>Fe,碳与氧化铝不反应,说明活动性Al>C,所以C、Fe、Al的活动性顺序由强到弱为:Al>C>Fe。(2)A.碳在高温下,能将不活泼金属从其氧化物中置换出来,铜属于不活泼金属,所以碳与氧化铜能发生置换反应,正确;B.金属活动性顺序中,氢前的金属能与稀硫酸发生置换反应,锌位于氢前,故锌能与稀硫酸发生置换反应,正...查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味。某兴趣小组利用浓氨水和浓盐酸探究分子运动速度与相对分子质量的关系。
方案I:在两玻璃片上同时分别滴加少量相同体积的浓氨水和浓盐酸,将2张湿润的pH试纸分别置于距玻璃片上方15厘米处(如图甲),比较2张pH试纸变色的时间。
方案II :将一支约35厘米长的玻璃管水平放置,将一湿润的pH试纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图乙),观察pH试纸的颜色变化。

(1)方案I实验中,观察到两液滴间的上方出现白烟。针对此现象,你的合理猜想是________。
(2)请指出方案I的两点不足之处________。
(3)多次进行方案II的实验,均观察到试纸先变蓝色,得出相对分子质量越小分子运动速度越快的结论。为使该结论更具有普遍性,还应继续研究_________。
氨气与氯化氢气体发生反应生成固体 使用的气体有强烈的刺激性气味,对人体有害或污染空气;在开放的空间进行实验,实验结果易受环境影响,如空气流动等 其它物质的分子运动速度与相对分子质量的关系 【解析】(1)白烟是白色固体,两液滴间的上方出现白烟,说明氨气与氯化氢气体发生反应生成固体。(2)方案I的两点不足之处:使用的气体有强烈的刺激性气味,对人体有害或污染空气;在开放的空间进行实验,实验结果易受...查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
镉是重金属污染中最受关注的元素之一。已有研究表明,秋华柳对镉具有较强的耐受和富集能力。为研究秋华柳受镉污染时,体内金属元素含量的变化。选取生长基本一致的幼苗,在不同镉离子浓度的土壤中进行分组实验。18天后测量植株各部分金属元素的含量,结果如图。

(1)由图可知,秋华柳叶片铁元素含量与镉离子浓度的关系是______。
(2)由实验结果可知,秋华柳______的变化可作为其受镉污染程度的指示。
(3)对镉污染土壤进行治理可采用化学沉淀法,即将土壤溶液中的镉离子形成沉淀物而降低污染。已知氯化镉易溶于水,碳酸镉和氢氧化镉难溶于水。下列物质可用于处理土壤镉污染的是______。
A.氢氧化钠 B.氢氧化钙 C.碳酸钙 D.氯化钠
镉离子浓度较低时,叶片中的铁元素含量影响不明显;达到一定浓度时,铁元素含量明显下降;浓度继续升高,铁元素含量基本不变 根中铁、镁、锌金属元素的含量 B 【解析】(1)由图看出,镉离子浓度较低时,对叶片中的铁元素含量影响不明显;达到一定浓度时,铁元素含量明显下降;浓度继续升高,铁元素含量基本不变。(2)由实验结果可知,秋华柳根中铁、镁、锌金属元素的含量的变化可作为其受镉污染程度的指示。(3)A...查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:填空题
《中国居民膳食指南》建议成人平均每天食盐摄入量应在6克以下。据调查,我国成人平均每天食盐摄入量为10.5克。
(1)高盐饮食容易引发______。
A.传染病 B.遗传病 C.心血管疾病
(2)人体摄入食盐后,主要在______被吸收进入血液循环。
(3)某品牌低钠盐含氯化钠70%,氯化钾30%。若某人每天摄入食盐6克,现以该低钠盐代替食盐,则每天可减少______________克钠元素的摄入? (结果精确到0.1)
C 小肠 0.7g 【解析】(1)高盐饮食容易引发心血管疾病。(2)人体摄入食盐后,主要在小肠内被吸收进入血液循环。 (3)6克低钠盐比6g食盐减少的氯化钠的质量:6克×30%=1.8g 氯化钠中钠元素的质量分数:×100%≈39.3% 每天可减少钠元素的摄入量:1.8g×39.3%≈0.7g查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:计算题
某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
0.22g 符合 【解析】(1)将0.53g碳酸钠加入足量稀盐酸中,则碳酸钠完全反应,设生成二氧化碳的质量是x。 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 106 44 0.53g x =,解得x=0.22g (2)第1次反应后,装置总质量减少的质量是:66.33克-66.19克=0.14克。因为装置减少的重力=气球受到的浮力,F浮...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com