
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:单选题
20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 | 第一组 | 第二组 | 第三组 | 第四组 |
水的质量/g | 50 | 50 | 50 | 50 |
所取NaCl的质量/g | 15 | 20 | 25 | 30 |
剩余NaCl的质量/g | 0 | 2 | 7 | 12 |
下列说法错误的是
A. 20℃时,50gNaCl饱和溶液中含有18gNaCl
B. 用蒸发的方法可以使不饱和溶液变成饱和溶液
C. 第二组所得溶液的溶质与溶剂的质量比为9:25
D. 相同温度下,NaCl在水里的溶解度与水的质量无关
A 【解析】结合第二、第三、第四组实验中剩余固体的质量,知道20℃时50g水中最多能溶解18gNaCl。A. 20℃时,68gNaCl饱和溶液中含有18gNaCl,错误;B. 用蒸发的方法可以使不饱和溶液变成饱和溶液,正确;C. 第二组所得溶液的溶质与溶剂的质量比为(20-2):50=9:25,正确;D. 相同温度下,NaCl在水里的溶解度与水的质量无关,正确。故选A。查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:单选题
向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是

A. A B. B C. C D. D
B 【解析】A、设与20g10%氢氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为x,20g10%氢氧化钠溶液中所含氢氧化钠的质量是:20g×10%=2g。 NaOH + HCl == NaCl + H2O 40 36.5 2g 7.3%×x =,解得x=25g,所以A错误;B、与20g10%氢氧化钠溶液恰好反应时,消耗7.3%的稀盐酸的质量为25g,正确;C、Q点...查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:填空题
如图是用铜丝绕成的锥形螺旋罩,置于酒精灯火焰上方。随着铜丝罩的垂直下移,可观察到酒精灯火焰越来越小,最终完全熄灭。

(1)铜丝在空气中受热,表面会产生黑色的_______(填化学式)。
(2)表面变黑的铜丝下移过程中遇到酒精蒸气,又会变光亮的红色,这是因为黑色物质发生了_______反应。(填“氧化”或“还原“)
(3)铜丝具有良好的导热性,能将热量很快散失,使酒精蒸气的温度低于_______,从而使酒精灯火焰熄灭。
CuO; 还原; 着火点 【解析】(1)铜在加热条件下,与氧气反应生成黑色的氧化铜(CuO)。(2)氧化铜是黑色固体,铜是红色固体,CuO→Cu,氧化铜中的氧元素失去,发生的是还原反应。(3)当可燃物的温度低于着火点时,可燃物不能燃烧。查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:推断题
如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
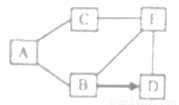
(1)A物质是________(填化学式)。
(2)C与E反应的基本类型是________。
(3)从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有________(填序号)。
①2类 ②3类 ③4类 ④5类
Fe; 复分解反应; ③ 【解析】五种物质中能两两发生反应且能与三种物质反应的是Ca(OH)2,所以E是Ca(OH)2,所给物质中,不能与Ca(OH)2反应的是Fe,则A是Fe。既能与Fe反应又能与Ca(OH)2反应的是HCl、 CuSO4,则D是MgCl2,HCl→MgCl2,故B是HCl,C是CuSO4。(1)A物质是 Fe。(2)C与E的反应是:CuSO4 + Ca(OH)2 == C...查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:科学探究题
小科从标签得知雪碧成分中有水、二氧化碳、柠檬酸、柠檬酸钠等。查阅资料知道1体积雪碧中含有约3体积二氧化碳,柠檬酸的含量约为2.8g/1000mL。柠檬酸与碳酸钠反应的化学方程式为:
2C6H8O7+3Na2CO3==2C6H5O7Na3+3CO2↑+3H2O。
他用一瓶500mL的雪碧做了如下实验:。
实验步骤 | 步骤一 | 步骤二 | 步骤三 | 步骤四 |
操作过程 | 倒出三分之二雪碧,测其pH | 在剩余雪碧中加入约6g Na2CO3 | 立即盖上瓶盖,摇匀。 | 测溶液pH |
现象或结果 | pH约为3 | 产生大量气泡 | 气泡消失,瓶子略瘪 | pH约为9 |
(发现问题)CO2去哪儿了?
(提出猜想)①CO2被溶解了;②CO2与H2O发生了反应;③CO2与Na2CO3溶液发生了反应。小思否定了猜想①和②,其理由是___________。
(设计实验)对猜想③进行实验探究。
实验编号 | 实验一 | 实验二 | 实验三 | 实验四 |
实验装置 |
|
|
|
|
操作过程 | Na2CO3溶液中滴加CaCl2溶液 | Na2CO3溶液中通入过量CO2后,滴加CaCl2溶液 | 收集一瓶CO2,加入30mL饱和Na2CO3溶液,盖上瓶盖摇匀 | 将实验三的溶液低温蒸发、干燥,得到的白色粉末按如图所示装置进行实验 |
实验現象 | 产生白色沉淀 | 无明显变化 | 瓶变瘪,瓶底有晶体析出 | A试管口有水滴,澄清石灰水变浑浊 |
根据实验探究过程,回答下列问题:
(1)设计实验一的作用是________ 。
(2)实验四中A试管口略向下倾斜,其目的是_______ 。
(3)根据实验探究得出:CO2与Na2CO3溶液反应的化学方程式:_________。
原CO2在溶液中已经饱和 与实验二对照; 防止试管口冷凝的水倒流导致试管底部破裂 CO2+Na2CO3+H2O==2NaHCO3 【解析】【提出猜想】原CO2在溶液中已经饱和,所以猜想①和②是错误的。 (1)设计实验一的作用是与实验二对照。(2)实验四中A试管口略向下倾斜,其目的是防止试管口冷凝的水倒流导致试管底部破裂。(3)根据实验探究得出:CO2与Na2CO3溶液反应的化学方程式:...查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:填空题
丁酸乙酯是无色有菠萝香味的液体,其密度为0.87g/cm3,难溶于水,可与油类互溶。现取11.6g丁酸乙酯在氧气中完全燃烧,只产生26.4gCO2和10.8gH2O。
(1)含有丁酸乙酯的物品应远离火源。若丁酸乙酯燃烧,____ (填“能”或不能”)用水来灭火。
(2)丁酸乙酯可与油类互溶,这种性质属于______性质。
(3)丁酸乙酯中碳元素和氢元素的质量比为______。
不能; 物理; 6:1 【解析】(1)丁酸乙酯难溶于水,且密度比水的密度小,如果用水灭火,丁酸乙酯浮在水的上面,仍然与空气接触,所以丁酸乙酯燃烧不能用水来灭火。(2)溶解性属于物理性质。(3)化学反应前后各种元素的质量相等,生成的二氧化碳中碳元素的质量等于丁酸乙酯中碳元素的质量,生成的水中氢元素的质量等于丁酸乙酯中氢元素的质量,所以丁酸乙酯中碳元素和氢元素的质量比为:(26.4g×):(10...查看答案和解析>>
科目: 来源:浙江省宁波市2018年中考科学(化学部分)试卷 题型:计算题
为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为_______。
(2)第_____组实验恰好完全反应。
(3)铁屑中铁的质量分数为多少___________? (计算结果精确到0.1%)
(4)原混合溶液中FeCl2 的质量分数为多少______________? (计算结果精确到0.1%)
12.8四93.3%15.9% 【解析】 (1)结合第一组与第二组实验可知,6g的铁屑与足量混合溶液反应生成6.4g铜,则12g铁屑与足量混合溶液反应可生成12.8g铜,第四组实验中,当铁屑质量增多时,析出铜的质量也增多,由此可知,第三组实验中,混合溶液是足量的,即铁屑完全反应,所以m=12.8g。(2)第五组实验中,铁屑质量增多,但析出铜的质量没有增多,说明第四组实验是恰好反应。(3...查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:单选题
下图为自米水生产过程示意图。下列说法正确的是

A. 清水池中的水是溶液 B. 过滤池中主要发生化学变化
C. 消毒用的液氯是化合物 D. 供水系统流出的水是纯净物
A 【解析】A. 溶液是具有均一性、稳定性的混合物,清水池中的水溶于可溶性物质,是溶液,正确;B. 通过过滤除去难溶性的固体物质,所以过滤池中主要发生物理变化,错误;C. 消毒用的液氯是单质,错误;D. 供水系统流出的水中仍溶有物质,是混合物,错误。故选A。查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:单选题
电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是SiO2)为原料制取,其中一步反应为:SiO2+2C Si+2CO↑。对该反应分析正确的是
Si+2CO↑。对该反应分析正确的是
A. 该反应属于置换反应 B. 碳发生了还原反应
C. 碳元素化合价由0价变为+4价 D. 该反应利用了CO的还原性
A 【解析】A. 由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应,该反应属于置换反应,正确;B. 反应后化合价升高的物质发生的是氧化反应,碳发生了氧化反应,错误;C. 碳元素化合价由0价变为+2价,错误;D. 该反应利用了C的还原性,错误。故选A。查看答案和解析>>
科目: 来源:浙江省台州市2018年中考化学试卷 题型:单选题
肝脏中含有过氧化氢酶。某同学利用动物肝脏研究酶的某些特点,实验记录如下表:
试管 | 实验材料及处理 | 产生气泡快慢 |
1 | 5毫升5%H2O2溶液+2滴蒸馏水,常温 | 最慢 |
2 | 5毫升5%H2O2溶液+2滴3.5%FeCl3溶液,常温 | 较快 |
3 | 5毫升5%H2O2溶液+2滴肝脏研磨液,常温 | 最快 |
4 | 5毫升5%H2O2溶液+2滴肝脏研磨液,70℃水浴加热 | 较慢 |
分析实验结果,无法得出过氧化氢酶
A. 具有专一性 B. 能加快过氧化氢分解
C. 具有高效性 D. 活性受温度影响
A 【解析】A. 该实验中只是做了过氧化氢酶能否加快过氧化氢溶液的分解,没有与其它反应做对比实验,所以无法得出过氧化氢酶具有专一性,错误;B. 实验1与实验3对比,说明过氧化氢酶能加快过氧化氢分解,正确;C. 实验1与实验3对比,说明过氧化氢酶具有高效性,正确;D. 实验3与实验4对比,说明过氧化氢酶活性受温度影响,正确。故选A。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com